C6. Géométrie et polarité des entités chimiques
Connaître la géométrie des molécules est très important si on veut bien comprendre les propriétés chimiques et physiques de ces molécules. Ceci est également vrai pour les ions.
Qu’est-ce qui permet de prévoir la géométrie du molécule ?
Quelle implication peut avoir la géométrie sur les propriétés physico-chimiques d’une molécule ?
C’est ce que nous allons voir dans ce chapitre.
Répartition des électrons
- Établir le schéma de Lewis de molécules et d’ions mono ou polyatomiques, à partir du tableau périodique : $*\ce{O2}*$, $*\ce{H2}*$, $*\ce{N2}*$, $*\ce{H2O}*$, $*\ce{CO2}*$, $*\ce{NH3}*$, $*\ce{CH4}*$, $*\ce{HCl}*$, $*\ce{H+}*$, $*\ce{H3O+}*$, $*\ce{Na+}*$, $*\ce{NH4+}*$, $*\ce{Cl–}*$, $*\ce{OH–}*$, $*\ce{O^2–}*$ .
Couches électroniques
Les électrons d’un atome se répartissent autour du noyau dans des couches et sous-couches électroniques. Vous avez déjà vu ça en seconde. Cette année, on va entrer un peu plus dans le détail avec les « sous-couches ».
Le tableau ci-dessous présentent les trois premières couches en partant du noyau.
| Couche n° | Sous-couches | Lettre |
|---|---|---|
| 1 | 1s | K |
| 2 | 2s ; 2p | L |
| 3 | 3s ; 3p ; 3d | M |
| 4 | 4s ; 4p ; 4d ; 4f | N |
La sous-couche s peut accueillir 2 électrons
La sous-couche p peut accueillir 6 électrons
La sous-couche d peut accueillir 10 électrons (ne sera pas vue au lycée).
Règles de remplissage
Connaître la structure électronique d’un atome, c’est-à-dire la distribution des électrons dans les différentes couche et sous-couches, est très utile.
Les électrons se répartissent dans ces couches en remplissant d’abord les couches et les sous-couches de plus basse énergie, c’est à dire le plus proche du noyau
Donc, le remplissage des couches et sous-couches suit cet ordre :
| • d’abord la couche 1s : | 1s1 → 1s2 ; |
| • puis la sous-couche 2s : | 1s22s1 → 1s22s2 ; |
| • puis la sous-couche 2p : | 1s22s22p1 → 1s22s22p6 ; |
| • Et on continue avec la couche n°3, en commençant par la sous-couche 3s, puis 3p. | |
Au-delà (couche 3d, couche 4s), le remplissage est plus irrégulier et ne sera pas vu au lycée.
Exemples : 1s22s1 → [He]2s1 ; 1s22s22p63s23p3 → [Ne]3s23p3.
Couche externe
La dernière couche contenant des électrons est appelée couche externe. Elle contient les électrons de valence (encore appelé électrons célibataires), c’est à dire ceux éventuellement capables de former des liaisons covalentes. C’est elle qui confère ses propriétés chimiques à un élément, c’est donc elle la plus importante pour un chimiste.
Électrons célibataires et doublets non liants
Si une couche (couche n°1, n°2 ou n°3, en ignorant la sous-couche 3d) contient plus que la moitié de son nombre maximum d’électrons, certains électrons s’associent par paire pour former un doublet non liant (notés DNL dans la suite).
Vous pouvez vous imaginez la couche n°2 ou la couche n°3 (hors sous-couche 3d) comme un tableau de 2 colonnes et 4 lignes, chaque case pouvant accueillir un électron (ça fait donc 8 électrons en tout, 2 pour la sous-couche s et 6 pour la sous-couche p).
Pour les remplir, il faut d’abord remplir la première colonne (exemples 1 et 2, avec respectivement 3 et 4 électrons), puis la deuxième (exemples 3 et 4 avec respectivement 5 et 6 électrons).
S’il y a deux électrons sur la même ligne, alors ils forment un doublet non liant (en rouge). Sinon, il s’agit d’électrons célibataires (en noir).
| • | |
| • | |
| • | |
| • | |
| • | |
| • | |
| • |
| • | • |
| • | |
| • | |
| • |
| • | • |
| • | • |
| • | |
| • |
Couches externes à connaître par cœur
Les doublets non liants sont représentés par une barre, les électrons célibataires par un point.
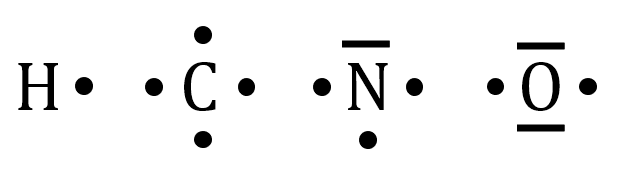
Couche externe
Retrouver le nombre de doublets non liants et d’électrons célibataires des atomes d’hydrogène, de carbone, d’azote et d’oxygène.
Correction
| • |
1s1
| • | |
| • | |
| • | |
| • |
[He] 2s2 2p2
| • | • |
| • | • |
| • | |
| • |
[He] 2s2 2p4
| • | • |
| • | |
| • | |
| • |
[He] 2s2 2p3
Stabilité des atomes
Les atomes sont plus stables lorsque leur couche externe est saturée (règle du duet si la couche externe est la couche n°1, règle de l’octet si la couche externe est la couche n°2 ou n°3).
Pour cela, il y a deux solutions : perdre ou gagner un ou des électrons pour former un ion, ou bien former une liaison covalente en partageant un (ou plusieurs) électron(s) célibataire(s) avec un autre atome.
Liaison covalente
Une liaison covalente simple entre deux atomes est la mise en commun de deux électrons célibataires, un de la part de chaque atome. Ces deux électrons constituent un doublet liant (synonyme de liaison covalente). Chaque atome comptabilise comme sien chacun des deux électrons, cela leur permet d’obéir à la règle de l’octet.
Exemple du méthane
$*\ce{C}*$ : 4 e– célibataire sur sa couche externe → 4 liaisons covalentes.$*\ce{H}*$ : 1 e– célibataire sur sa couche externe → 1 liaison covalente.
En formant la molécule de méthane, chaque atome obéit aux règles du duet et de l’octet : chaque hydrogène est entouré de deux électrons, et l’atome de carbone est entouré de 8 électrons.
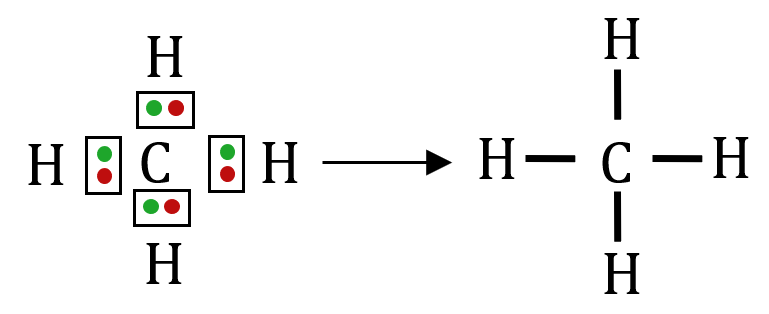
Ions
Un atome peut également obéir aux règles du duet et de l’octet en perdant ou un gagnant un ou plusieurs électrons pour devenir un ion.
Exemple d’ion monoatomique
L’ion $*\ce{Cl–}*$ a pour structure électronique [Ne]3s23p6. Sa couche externe (couche n°3) est saturée (la couche 3d n’est pas impliquée ici), d’où sa grande stabilité.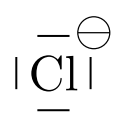
Il existe aussi des ions polyatomiques, comme $*\ce{H3O+}*$ ou $*\ce{NH4+}*$ par exemple.
Exemple d’ion polyatomique
L’ion $*\ce{H3O+}*$ est l’association de 3 atomes d’hydrogène et d’un atome d’oxygène auquel il manque un électron :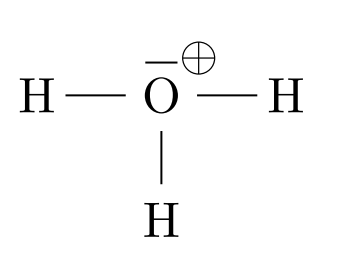
Remarque : pour des raisons que nous verrons plus loin, la charge + est portée par l’ensemble de la structure et pas par un atome en particulier.
Schéma de Lewis
Le schéma de Lewis (aussi appelée formule de Lewis) d’une molécule fait apparaître les doublets non liants portés par certains atomes.
Lacune électronique
Une lacune électronique est un déficit de deux électrons par rapport aux règles de stabilité. Elle est indiqué par une case vide.
Le bore possède 3 e– sur sa couche externe. Il possède donc 3 électrons célibataires. Lorsqu’il forme trois liaisons, il peut encore recevoir 2 e– sur sa couche externe.
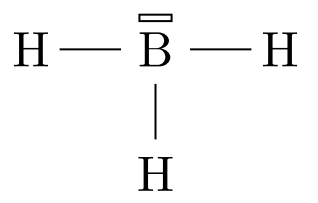
Schéma de Lewis
Donner les formules des Lewis des ions et molécules suivants :
$*\ce{O2}*$, $*\ce{H2}*$, $*\ce{N2}*$, $*\ce{H2O}*$, $*\ce{CO2}*$, $*\ce{NH3}*$, $*\ce{HCl}*$, $*\ce{H+}*$, $*\ce{Na+}*$, $*\ce{NH4+}*$, $*\ce{OH–}*$, $*\ce{O^2–}*$.
Correction
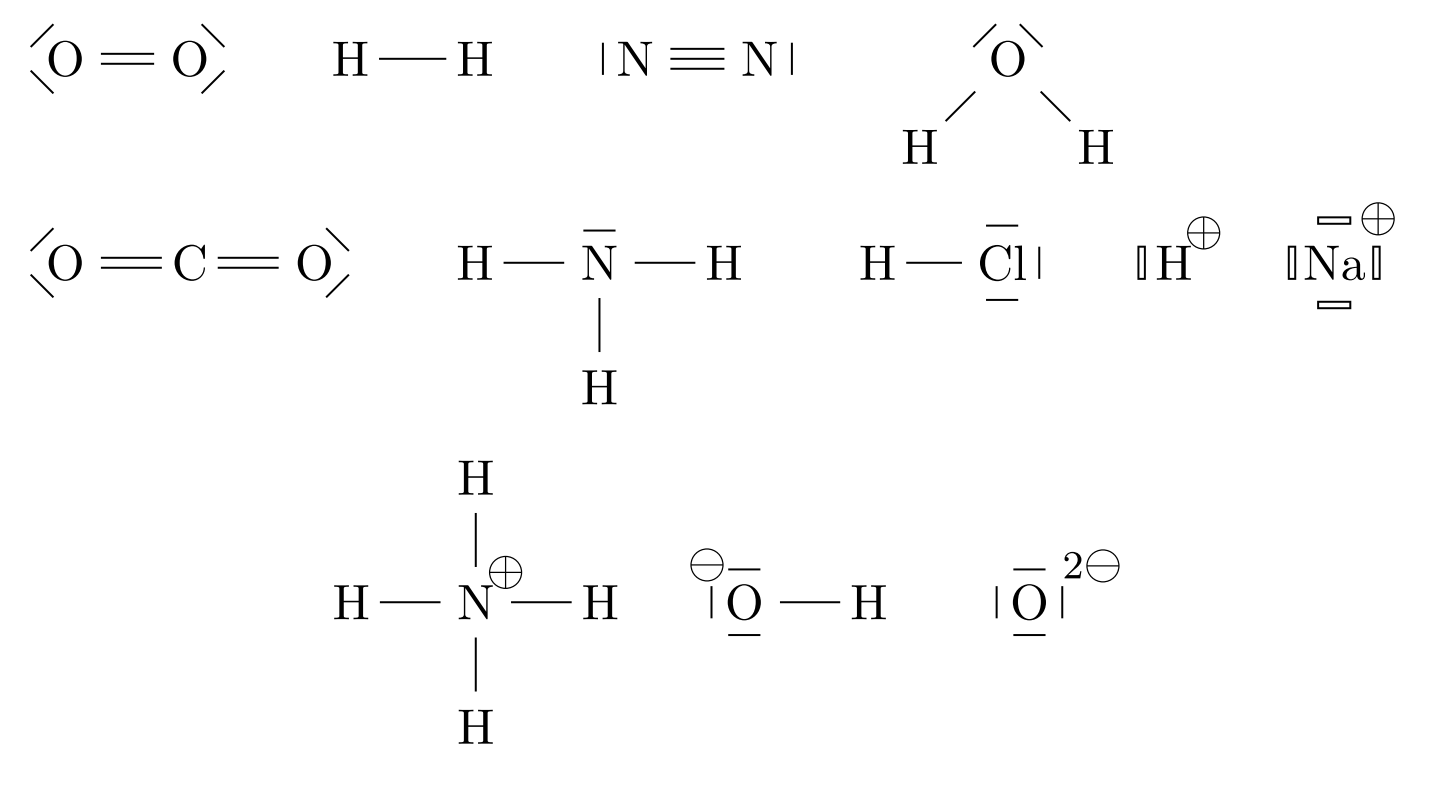
Géométrie des entités chimiques
- Interpréter la géométrie d’une entité à partir de son schéma de Lewis.
Activité Géométrie des molécules
- Utiliser des modèles moléculaires ou des logiciels de représentation moléculaire pour visualiser la géométrie d’une entité.
Objectif : visualiser la géométrie de quelques molécules ayant un unique atome central à l’aide de modèle moléculaire et de Chemsketch.
Première approche
- Gonfler quatre ballons de baudruche et les attacher ensemble par leur valve. Observer l’agencement géométrique des ballons. Comment l’expliquer ?
- Que se passe-t-il s’il n’y a que trois ballons attachés ensemble ?
Utilisation de Chemsketch
Chemsketch est un logiciel de chimie aux nombreuses fonctionnalités. Une version gratuite est proposée par ACD/Labs pour les étudiants et les professeurs. Ce logiciel ne fonctionne que sous Windows 64 bits.
Utiliser Chemsketch pour afficher une représentation 3D des molécules ci-dessous. Justifier la géométrie des liaisons autour de l’atome central.
- Méthane $*\ce{CH4}*$
- Méthanal $*\ce{H2CO}*$
- Dioxyde de carbone $*\ce{CO2}*$.
- Eau $*\ce{H2O}*$
- Ammoniac $*\ce{NH3}*$
On peut prévoir la répartition spatiale des doublets liants et non liants autour d’un atome et tenant compte du fait que ces doublets exercent les uns sur les autres une force électrique répulsive.
En effet, ces doublets, qu’ils soient non liant ou liant, sont en fait des… électrons. Ils sont donc chargés négativement et se repoussent les uns les autres.
Ils s’arrangent alors dans l’espace de manière à minimiser ces répulsions, c’est-à-dire à être le plus loin possible les uns des autres.
Attention : une liaison double ou triple compte, en matière de géométrie, comme un seul doublet. En effet, les électrons impliqués dans ce type de liaison sont forcés d’être « proches » les uns des autres.
Le tableau ci-dessous montre les différentes géométries possibles de répartition des doublets autour d’un atome central, avec leur appellation. En rouge : l’atome central, en blanc : un autre atome, en jaune : DNL.
| Nbre total de doublets | 0 DNL | 1 DNL | 2 DNL | 3 DNL |
|---|---|---|---|---|
| 1 | 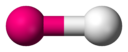 | |||
| 2 |  linéaire |
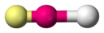 |
||
| 3 | 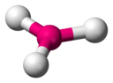 trigonale plane |
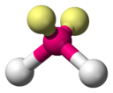
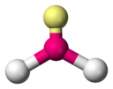 coudée |
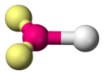 |
|
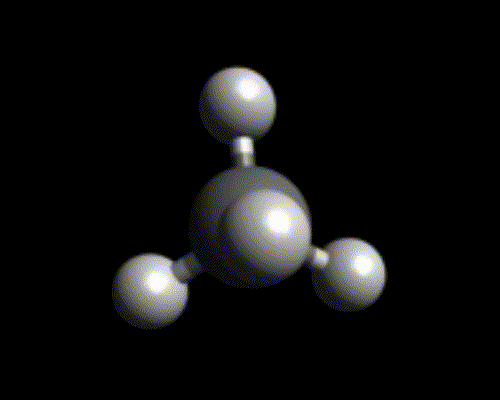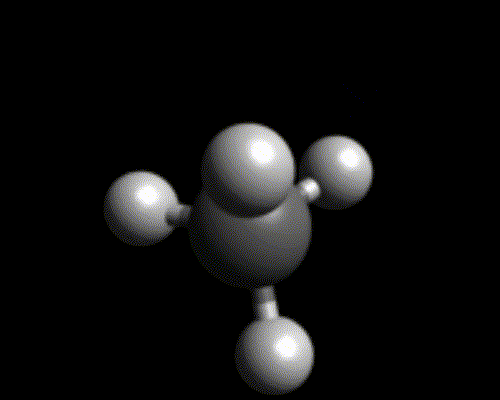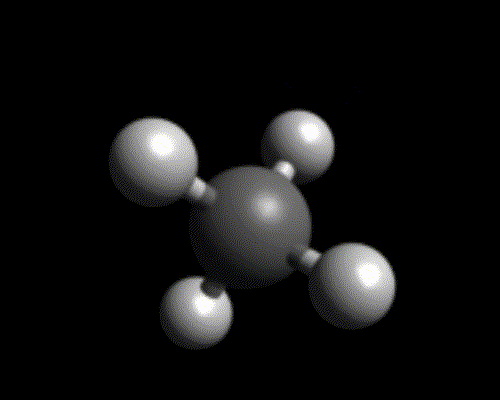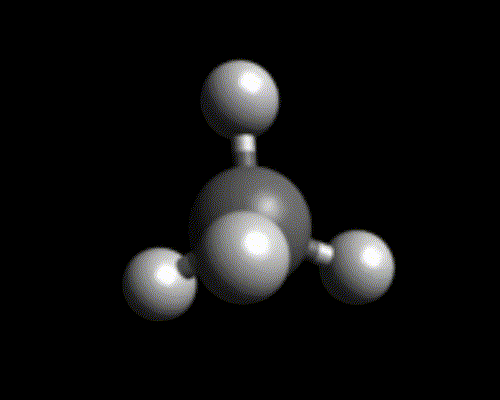
| 4 | 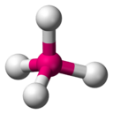 tétraédrique |
 pyramidale |
 coudée |
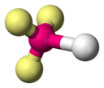 |
Géométrie des molécules
Pour chacun des exemples donnés dans le tableau ci-dessus, proposer une molécule simple ayant cette géométrie.
Correction
- Linéaire : il faut un atome central qui n’a pas de doublet non liant et qui peut faire 2 liaisons (simple, double ou triple).
Exemples : $*\ce{BeH2}*$, $*\ce{HCN}*$, $*\ce{CO2}*$. - Coudée : il faut un atome avec un ou deux doublets non liant(s) (oxygène, soufre, azote, phosphore) et formant deux liaisons (simple ou double).
Exemples : $*\ce{H2O}*$, $*\ce{HNO}*$, $*\ce{NH2^-}*$. - Trigonale plane : il faut un atome central sans doublet non liant et formant trois liaisons.
Exemples : $*\ce{BH3}*$, $*\ce{H2CO}*$. - Pyramidale : il faut un atome centrale avec un doublet non liant et capable de faire trois liaisons (azote ou phosphore)
Exemples : $*\ce{NH3}*$, $*\ce{PH3}*$. - Tétraédrique : il faut un atome central pouvant former 4 liaisons.
Exemples : $*\ce{CH4}*$, $*\ce{NH4^+}*$, $*\ce{SiH4}*$.
Polarité d’une molécule
- Déterminer le caractère polaire d’une liaison à partir de la donnée de l’électronégativité des atomes.
- Déterminer le caractère polaire ou apolaire d’une molécule à partir de sa géométrie et de la polarité de ses liaisons.
Électronégativité
L’électronégativité d’un élément est sa capacité à attirer à lui les électrons d’une liaison covalente.
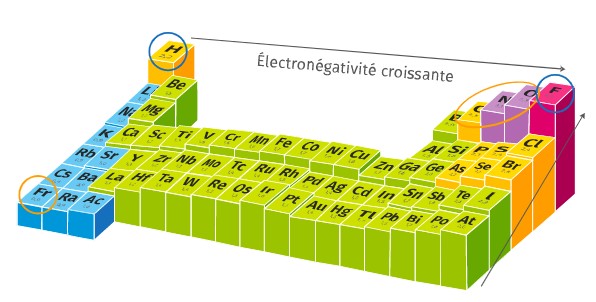
Par exemple, l’électronégativité de l’oxygène $*\chi(\ce{O})*$ est sensiblement supérieure à celle de l’hydrogène $*\chi(\ce{H})*$. Donc dans une liaison covalente $*\ce{O-H}*$, les deux électrons impliqués (celui de l’oxygène et celui de l’hydrogène) sont plus souvent « autour » de l’oxygène qu’autour de l’hydrogène. Le partage n’est pas « équitable » à cause de cette différence d’électronégativité.
Et ceci a une conséquence très importante. Tellement importante, que sans elle, nous n’existerions pas ! 😁
Polarisation d’une liaison covalente
Quand deux atomes d’électronégativité différente sont liés, celui qui est le plus électronégatif attire à lui les électrons de la liaison covalente.
Il s’ensuit un déséquilibre de la répartition de charge entre les deux atomes, avec apparition d’une petite charge (–) sur l’élément le plus électronégatif et apparition d’une petite charge (+) sur l’élément le moins électronégatif. On dit que la liaison est polarisée. L’ensemble reste globalement neutre.
On considère qu’une liaison est polarisée si la différence d’électronégativité des deux atomes liés est supérieure à 0,4 environ (voir le lien pour avoir ces valeurs).
Bien sûr, une liaison covalente liant deux atomes d’électronégativités identiques ou voisines n’est pas polarisée.
Liaisons non polarisées fréquentes : $*\ce{H-H}*$, $*\ce{O=O}*$, $*\ce{C-H}*$
On a l’habitude de noter δ+ la « petite » charge portée par l’atome le moins électronégatif de la liaison, et δ– la « petite » charge portée par l’atome le plus électronégatif.
Pourquoi « petite » ? Tout simplement parce cette charge est bien plus petite que celle portée par un ion.
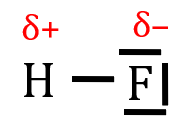
Polarité d’une molécule
Une molécule est polaire si la position moyenne de ses charges δ– ne coïncide pas avec la position moyenne de ses charges δ+.
Ainsi, le fait qu’une molécule ait des liaisons polarisées est une condition nécessaire mais non suffisante pour qu’elle soit polaire. En effet, la polarisation des différentes liaisons peut s’annuler à cause de la géométrie de la molécule.
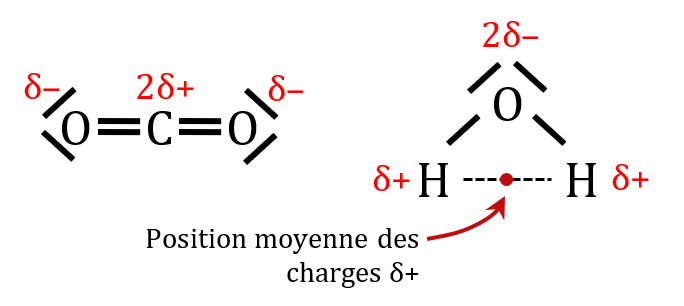
Dans la molécule d’eau, les liaisons $*\ce{O–H}*$ sont polarisées. La position moyenne des charges δ+ portées par les atomes d’hydrogène se trouve entre les deux hydrogène. Elle ne coïncide pas avec la position moyenne des charges δ– qui se trouve sur l’oxygène. La molécule d’eau est donc polaire.
Dans la molécule de $*\ce{CO2}*$, les liaisons $*\ce{C=O}*$ sont polarisées. Mais la position moyenne des charges δ– se trouve sur le carbone car la molécule de $*\ce{CO2}*$ a une géométrie linéaire. Les positions des charges δ– et δ+ coïncident, donc la molécule de $*\ce{CO2}*$ n’est pas polaire malgré la présence de liaisons polarisées.
Molécules polaires et apolaires
Indiquer si les molécules suivantes sont polaires ou non, en justifiant :
cyclohexane $*\ce{C6H12}*$ ; dichlorométhane $*\ce{CH2Cl2}*$ ; tétrachlorométhane $*\ce{CCl4}*$ ; éthanol $*\ce{CH3–CH2–OH}*$ ; acétone $*\ce{CH3–CO–CH3}*$
Correction
Cyclohexane : il ne comporte que des liaisons $*\ce{C-C}*$ et $*\ce{C-H}*$ (c’est un hydrocarbure). Il n’a pas de liaisons polarisées et est donc apolaire.
Dichlorométhane : deux liaisons polarisées $*\ce{C-Cl}*$ dans une molécule tétraédrique. Ces polarisations ne peuvent pas se compenser par symétrie. C’est donc une molécule polaire.
Tétrachlorométhane : quatre liaisons polarisées, mais ces polarisations se compense pas symétrie. Le tétrachlorométhane est apolaire.
Éthanol : deux liaisons polarisées $*\ce{C-O}*$ et $*\ce{O-H}*$. Ces liaisons ont une géométrie coudée autour de l’oxygène. Leur polarisation ne peuvent donc pas se compenser. L’éthanol est donc polaire.
Acétone : une seule liaison polarisée $*\ce{C=O}*$. Cette molécule est donc forcément polaire.
Révision & entraînement
Quand ça tourne au vinaigre
Cet exercice a été donné en devoir en devoir en 2020/2021.
Pour fabriquer du vinaigre, il suffit de laisser un certain une boisson faiblement alcoolisée (vin, cidre…) en présence de dioxygène. L’éthanol $*\ce{CH3–CH2–OH}*$ contenu dans la boisson alcoolisée se transforme alors en acide éthanoïque $*\ce{CH3–CO2H}*$ en réagissant avec le dioxygène de l’air.
Données
- Couples redox : $*\ce{CH3–CO2H}*$ / $*\ce{CH3–CH2–OH}*$ et $*\ce{O2}*$ / $*\ce{H2O}*$
- Numéro atomique : $*Z*$(C) = 6 ; $*Z*$(O) = 8 ; $*Z*$(H) = 1
- Électronégativité : $*\chi*$(C) = 2,55 ; $*\chi*$(O) = 3,44 ; $*\chi*$(H) = 2,2 ;
- On considère qu’une liaison est polarisée si la différence d’électronégativité des deux atomes liés est supérieure à 0,4 environ (voir le lien pour avoir ces valeurs).
1.1. Écrire les demi-équations associées à chacun de ces deux couples.
1.2. En déduire l’équation-bilan de la réaction.
2. Donner le schéma de Lewis des molécules d’éthanol et d’acide éthanoïque. Votre schéma de Lewis doit respecter l’enchaînement des atomes indiqué dans les formules semi-développées.
3. Quelle géométrie adoptent les liaisons autour du carbone noté en gras dans l’éthanol $*\ce{CH3–\mathbf{C}H2–OH}*$ et dans l’acide éthanoïque $*\ce{CH3–\mathbf{C}O2H}*$ ?
4.1. Quelles sont les liaisons polarisées dans ces deux molécules ?
4.2. L’éthanol est-il polaire ? Justifier. Même question pour l’acide éthanoïque.
Correction
1.1 $*\ce{CH3–CO2H + 4H+ + 4e– = CH3–CH2–OH + H2O et O2 + 4e– + 4H+ = 2H2O}*$
1.2. $*\ce{CH3–CH2–OH + O2 → CH3–CO2H + H2O}*$
2. Shéma de Lewis
3. Dans l’éthanol : quatre liaisons et aucun doublet non liant → tétraedrique
Dans l’acide éthanoïque : trois liaisons et aucun doublet non liant → trigonale plane
4.1. Les liaisons $*\ce{C–O}*$, $*\ce{C=O}*$ et $*\ce{O–H}*$
4.2. L’éthanol est polaire car il a deux liaisons polarisées et ces liaisons ont une géométrie coudée. Leur polarisation ne peut pas s’annuler par symétrie.
L’acide éthanoïque est polaire aussi car il a trois liaisons polarisées dont la géométrie ne permet pas l’annulation de ces polarisations.