C8. Molécules organiques et spectres IR
Dans ce chapitre, nous allons nous intéresser aux différentes familles de molécules organiques, ainsi qu’aux spectres infrarouges.
Molécules organiques
- Identifier, à partir d’une formule semi-développée, les groupes caractéristiques associés aux familles de composés : alcool, aldéhyde, cétone et acide carboxylique.
- Justifier le nom associé à la formule semi-développée de molécules simples possédant un seul groupe caractéristique et inversement.
Une espèce organique est une molécule ou un ion dont un des éléments chimiques constitutifs est le carbone, à quelques exceptions près (voir ci-dessous). Ces composés peuvent être d’origine naturelle ou produits par synthèse.
Molécules et ions inorganiques contenant du carbone :
- Monoxyde et dioxyde de carbone $*\ce{CO}*$, $*\ce{CO2}*$
- L’acide carbonique $*\ce{H2CO3}*$ et ses dérivés : l’ion hydrogénocarbonate $*\ce{HCO3^–}*$ et l’ion carbonate $*\ce{CO3^2-}*$
- L’ion cyanure $*\ce{CN^-}*$
- Les différentes formes de carbone pur (graphite, diamant)
- Ainsi que tous les corps composés constitué de carbone et d’un deuxième élément moins électronégatif que le carbone – à l’exception de l’hydrogène – (par exemple le carbure de calcium $*\ce{CaC2}*$).
Chaîne carbonée
Les molécules organiques possédant plus d’un atome de carbone présentent un enchaînement d’atomes de carbone. Cet enchaînement constitue le squelette de la molécule, aussi appelé chaîne carbonée. Cette chaîne carbonée peut être linéaire, ramifiée et/ou cyclique
Alcanes
Une molécule organique ne contenant que des C et de H (ce qui en fait un hydrocarbure) et que des liaisons simples est appelé un alcane.
Les alcanes acycliques ont pour formule brute $*\ce{C_nH_{2n+2}}*$, les alcanes cycliques ont pour formule $*\ce{C_nH_{2n}}*$.
Nomenclature
Les chimistes ont inventé un système permettant de définir le nom (dit nom systématique) d’une molécule organique à partir de sa formule, et réciproquement – trouver la formule de la molécule à partir de son nom.
• Pour trouver le nom systématique d’un alcane, il faut d’abord repérer la plus longue chaîne carbonée. C’est elle qui va permettre de déterminer le radical du nom.
Dans la molécule ci-dessous, les carbone de la chaîne principale sont en rouge. Il y a deux ramifications, dont les carbone sont en vert.
En fonction du nombre d’atomes de carbone que comporte la chaîne carbonée principale, le radical du nom de la molécule change. La table ci-dessous indique le radical du nom en fonction de ce nombre.
| C | radical | C | radical |
|---|---|---|---|
| 1 | méth- | 5 | pent- |
| 2 | éth- | 6 | hex- |
| 3 | prop- | 7 | hept- |
| 4 | but- | 8 | oct- |
À ce radical s’ajoute le suffixe -ane, lorsque la molécule est un alcane (on verra d’autres familles un peu plus tard dans ce chapitre).
• Il faut ensuite tenir compte des éventuelles ramifications, c’est-à-dire de plus petites chaines carbonées venant se fixer à la chaîne principale. Elles apparaissent sous forme d’un préfixe indiquant la position de la ramification et le nombre de carbone.
On numérote les atomes de la chaîne carbonée de manière à ce que le numéro de la position du premier atome de C portant une ramification soit le plus petit possible.
Le nombre de carbone de chaque ramification (une ramification est appelé groupe alkyle) est indiqué par le même radical que pour la chaîne carbonée principale. Le nom d’une ramification est terminé par –yl. Dans l’exemple ci-dessus, il y a deux ramifications méthyle. Une sur le carbone n°2 et l’autre sur le carbone n°5.
Enfin, on place le nom de ces ramifications (méthyle, éthyle) devant le nom de la chaîne linéaire, dans l’ordre alphabétique, en la faisant précéder du numéro du carbone qui la porte. Le « e » final de ce nom est supprimé.
Si plusieurs ramifications identiques sont présentes, ces numéros sont groupés et on ajoute le préfixe di-, tri- ou tétra- devant le nom du groupe alkyle.
Quelques exemples de molécules ramifiées
Remarque n°1 : lorsque la chaîne est un cycle, on rajoute le préfixe cyclo : cyclohexane, cyclopentane, etc.
Remarque n°2 : il arrive que le numéro précédant le groupe alkyle soit inutile car sans ambigüité. Il doit être alors supprimé.
Pour rajouter un groupe méthyle sur une molécule de butane, on n’a pas le choix : si on l’ajoute à l’extrémité de la chaîne, on obtient du pentane. Si on l’ajoute comme une ramification, alors on le met sur le carbone n°2 ou n°3, on obtient toujours la même molécule. Donc le nom méthylbutane est sans ambigüité : il n’y a qu’une seule molécule possible associée à ce nom.
Nomenclature des alcanes
Nommer les molécules suivantes
| (a) | |
| (b) | |
| (c) | |
| (d) | |
| (e) | |
| (f) | |
| (g) | |
| (h) |
Correction
a. méthylpropane
b. diméthylpropane
c. 2,2-diméthylbutane
d. 2,3-diméthylbutane
e. 2,2,3-triméthylpentane
f. 2,2,3,4-tetraméthylhexane
g. méthylcyclohexane
h. 1,2-diméthylcyclohexane
Groupes caractéristiques
Certaines molécules organiques comportent des groupes d’atomes autres que C et H. Ces groupes d’atomes sont appelés groupes caractéristiques et définissent la famille à laquelle appartient une molécule donnée.
Nous allons voir dans ce chapitre 4 familles : les alcools, les aldéhdydes, les cétones et les acides carboxyliques.
Alcools
Un alcool a pour formule générale :
où R1, R2 et R3 représentent des groupes alkyles et/ou des hydrogène. Le groupe –OH est appelé groupe hydroxyle.
Nomenclature : même principe que les alcanes, avec les précisions supplémentaire ci-dessous.
- la terminaison est en « -ol » (méthanol, éthanol).
- la chaîne carbonée principale est la chaîne carbonée la plus longue qui inclut le carbone portant le groupe hydroxyle –OH (appelé carbone fonctionnel, car il porte la fonction alcool). La numérotation de la chaîne carbonée principale se fait toujours de manière à attribuer le plus petit numéro au carbone fonctionnel.
- il est souvent nécessaire d’indiquer la position du groupe hydroxyle –OH. Ce numéro est placé entre le an et le ol de la terminaison.
Exemples d’alcools
Nomenclature des alcools
Nommer les alcools suivants :
Correction
a. méthylpropan-2-olb. 3,4,4-triméthylpentan-2-ol
c. cyclohexanol
d. 2-méthylcyclohexanol
Aldéhydes
Un aldéhyde a pour formule générale :
où R représente un groupe alkyle ou un H. Le groupe C=O est appelé groupe carbonyle.
Nomenclature : comme les alcanes, avec terminaison en -al (méthanal, éthanal). La chaîne carbonée principale est la chaîne carbonée la plus longue qui inclut le carbone fonctionnel. La numérotation de la chaîne carbonée principale se fait toujours de manière à attribuer le n° 1 au carbone fonctionnel.
Cétones
Une cétone a pour formule générale :
où R1 et R2 sont deux groupes alkyles (pas des hydrogène, sinon, il s’agit d’un aldéhyde). Contrairement aux aldéhydes, le groupe carbonyle des cétones n’est jamais en bout de chaîne.
Nomenclature : terminaison en -one (propanone, butanone). La chaîne carbonée principale est la chaîne carbonée la plus longue qui inclut le carbone fonctionnel. La numérotation de la chaîne carbonée principale se fait toujours de manière à attribuer le plus petit numéro au carbone fonctionnel. La place du groupe carbonyle C=O doit être indiqué si nécessaire, comme dans le cas des alcools.
Exemples de cétones
Acide carboxylique
La formule générale des acides carboxyliques est :
où R représente un groupe alkyle ou un H. Le groupe –COOH est appelé groupe carboxyle.
Nomenclature : acide xxx-oïque (acide méthanoïque, acide éthanoïque…). La chaîne carbonée principale est la chaîne carbonée la plus longue qui inclut le carbone fonctionnel. La numérotation de la chaîne carbonée principale se fait toujours de manière à attribuer le n° 1 au carbone fonctionnel.
Autres nomenclatures
Nommer les molécules suivantes :
Correction
a. méthylpropanalb. butanal
c. butanone
d. 2-méthylcyclohexanone
e. Acide propanoïque
f. Acide méthylpropanoïque
Spectres infrarouges
- Exploiter, à partir de valeurs de référence, un spectre d'absorption infrarouge.
Vibration des liaisons covalentes
Les liaisons covalentes peuvent être visualisées comme de minuscules ressorts liant deux atomes. Elles peuvent vibrer en élongation ou en déformation. Comme pour l’électron en orbite autour d’un atome, l’énergie de vibration de ces liaisons est quantifiée, c’est-à-dire qu’elle ne peut prendre qu’un certain nombre de valeurs précises.
Si l’on envoie sur une liaison un photon ayant l’énergie adéquate (c’est-à-dire l’énergie correspondant à la différence entre deux niveaux d’énergie de vibration), la liaison pourra l’absorber et vibrer avec une plus grande amplitude.
Ces niveaux d’énergies dépendent du type d’atomes (ou groupe d’atome) liés.
Spectres infrarouges
Le spectre infrarouge d’une molécule est le tracé de la transmittance $*T*$ (pourcentage du signal transmis, c’est-à-dire non absorbé par la molécule) en fonction du nombre d’onde $*\sigma*$ (cm-1) qui est une grandeur proportionnelle à la fréquence.
Ce spectre, très complexe, est caractéristique d’une molécule. Il est possible d’en analyser certaines parties pour en déduire les groupes présents dans une molécule et ainsi avoir une idée de sa structure.
Un spectre s’analyse à l’aide d’un tableau résumant les nombres d’onde d’absorption des différents groupes.
| Liaison | Nombre d’onde (cm-1) |
|---|---|
| O-H sans liaison H | 3580-3670 (bande fine) |
| O-H avec liaison H | 3200-3400 (bande large) |
| O-H acide carboxylique | 2500-3200 |
| N-H | 3100-3500 |
| C-H | 2800-3080 |
| C-H aldéhyde | 2750-2900 |
| C=O | 1650-1740 |
| C=C | 1625-1450 |
La partie du spectre appelée « empreinte digitale » (pour des nombres d’ondes inférieurs à 1400 cm-1) est propre à la molécule et ne peut généralement pas être interprétée.
Exemple : spectre IR du pentan-2-ol
Dans le spectre ci-dessous, on peut voir l’absorption des liaisons O-H (alcool lié – bande 1) et celle des liaisons C-H (alcane – bande 2)
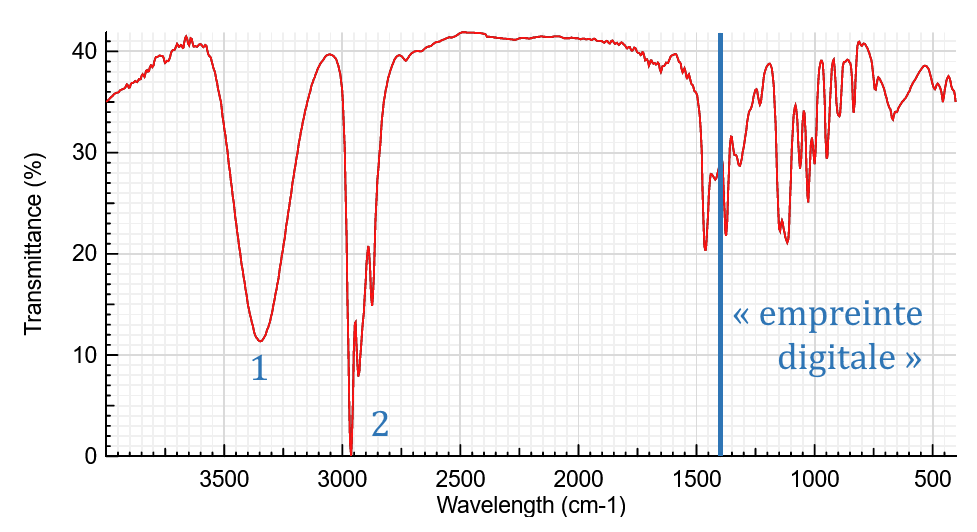
(à voir absolument)
Associer un spectre IR à une molécule
Les spectres infrarouges ci-dessous sont ceux de l’acide éthanoïque et du méthanoate de méthyle, une molécule de la famille des esters dont la formule est :
Attribuer ces spectres à chaque molécule en vous servant du tableau des nombres d’onde donné dans le cours.
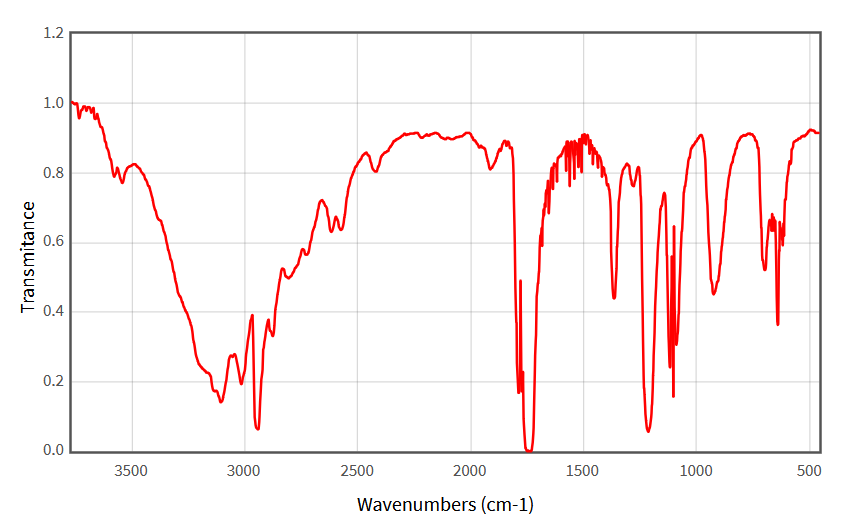
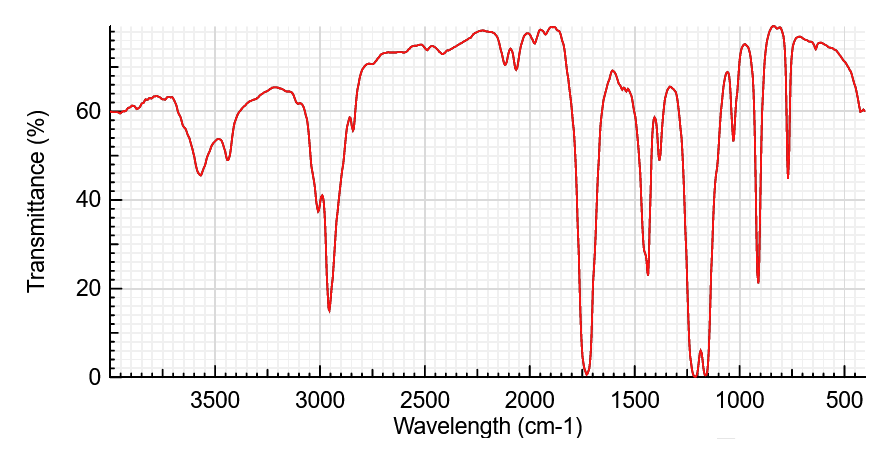
Correction
La large bande autour de 3.000 cm-1, sur le spectre n°1 et mais absente du spectre n°2, correspond à la liaison O–H de l’acide carboxylique. Il s’agit donc du spectre de l’acide méthanoïque.Par déduction, l’autre spectre correspond au méthanoate de méthyle.
Adrénaline – andrénalone
Le spectre ci-dessous est-il celui de l’adrénalone ou de l’adrénaline ?
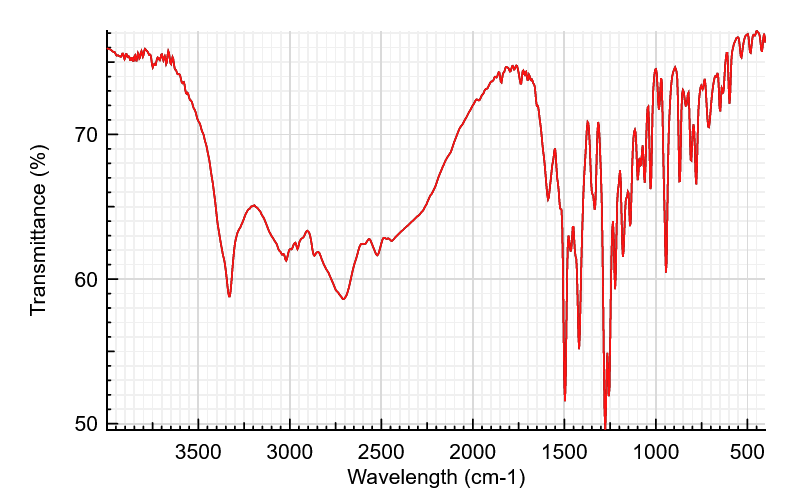
Correction
La seule différence entre ces deux molécules est la présence d’une double liaison C=O dans l’adrénalone, alors que cette liaison est absente dans l’adrénaline.Cette liaison se caractérise par une bande entre 1650 cm-1 et 1740 cm-1.
Or on ne voit rien de tel sur le spectre. Donc il s’agit du spectre de l’adrénaline.
Le paracétamol
Formule semi-développée du paracétamol :
Spectre infrarouge du paracétamol, réalisé en phase gazeuse :
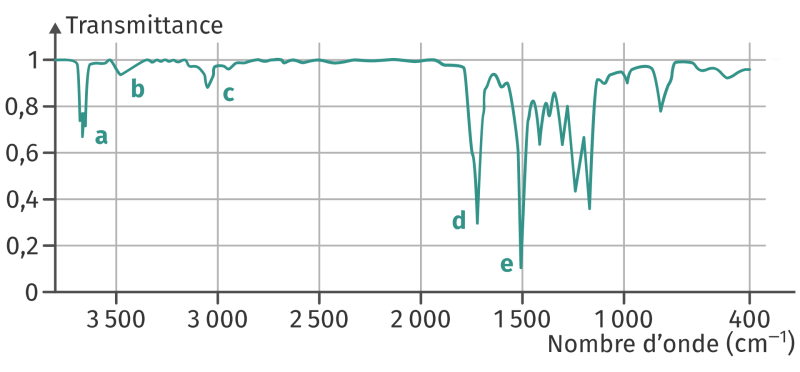
1. Attribuer à chaque bande d’absorption le groupe caractéristique correspondant.
2. Comment aurait été modifié ce spectre s’il avait été réalisé en phase liquide ? Pensez aux groupes –OH : que peuvent-ils faire en phase liquide et qui n’est pas possible en phase gazeuse ?
Correction
1. Attribution des bandes d’absorption aux différentes liaisons :
a : O–H sans liaison H
b : N–H (pas facile)
c : C–H (pas facile)
d : C=O
e : C=C
2. En phase liquide, des liaisons hydrogène auraient pu se former entre les molécules, par le groupe –OH. On aurait donc une bande large entre 3200 et 3400 cm-1.