C9. Synthèses organiques
Nous avons vu dans le chapitre précédent quelques familles de molécules et une méthode pour les identifier. Dans ce chapitre, nous aborderons quelques notions sur la synthèse de molécules organiques.
Étapes d’une synthèse
- Identifier, dans un protocole, les étapes de transformation des réactifs, d’isolement, de purification et d’analyse (identification, pureté) du produit synthétisé.
- Justifier, à partir des propriétés physico-chimiques des réactifs et produits, le choix de méthodes d’isolement, de purification ou d’analyse.
- Schématiser des dispositifs expérimentaux des étapes d’une synthèse et les légender.
Transformation des réactifs
Une synthèse organique est la fabrication d’une espèce chimique organique plus ou moins complexe, le plus souvent dans un solvant (un des réactifs peut parfois jouer ce rôle) en présence, parfois, d’un catalyseur.
Les réactifs de départ sont soit des molécules organiques simples extraites du pétrole, soit une molécule organique extraite de substances naturelles.
En général, une synthèse comporte une suite de plusieurs réactions chimiques, chacune permettant de s’approcher de la molécule souhaitée. Lorsqu’on ne s’intéresse qu’à une seule de ces réactions, on parle parfois d’hémisynthèse.
Pour ne pas surcharger l’écriture, on a l’habitude, en chimie organique, de ne noter pour chaque étape que la molécule de départ et la molécule d’arrivée. Il ne s’agit donc pas d’une équation-bilan. Les réactifs autres que la molécule de départ apparaissent parfois sur la flèche de réaction (ainsi que le catalyseur éventuel, où les conditions expérimentales) et on ne détaille pas les sous-produits (les produits de la réaction autres que ceux qui nous intéressent).
Exemple : synthèse de l’aspirine
On s’intéresse à la synthèse de l’aspirine à partir de molécules simples produites par la pétrochimie : le benzène et le propène.
Cette synthèse se fait en 4 étapes ci-dessous. On voit comment on part d’une molécule simple se trouvant directement dans le pétrole (le benzène) et comment, par une suite de réactions, on arrive à la molécule souhaitée.
Étape 1 : Synthèse du cumène à partir de benzène et de propène
Étape 2 : Synthèse du phénol par oxydation du cumène
Étape 3 : Synthèse de l’acide salicylique par réaction de Kolbe-Schmitt
Étape 4 : obtention de l’aspirine à partir de l’acide salicylique
Il faut bien garder à l’esprit que ces différentes étapes sont le fruit du travail de nombreux chimistes, qu’elles font souvent l’objet de dépôt de brevets, et que, si d’autres voies de formation de l’aspirine sont possibles, cette suite d’étape et celle qui, en l’état actuel des connaissances en chimie, présente le meilleur intérêt économique.
Le montage de chauffage à reflux
Il faut souvent (mais pas toujours !) chauffer les réactifs pour que la réaction se fasse. Pour cela, on a recours à la technique du chauffage à reflux (montage ci-dessous) qui permet d’éviter le problème de la surpression et la diffusion de vapeur dans le laboratoire.
Lors du chauffage, on ajoute souvent quelques grains de pierre ponce. Ces grains, très poreux, facilitent la formation de petites bulles lors de l’ébullition. Ils évitent donc les retards à l’ébullition responsables de l’apparition soudaine de très grosses bulles qui pourraient envoyer des projections dans le réfrigérant.
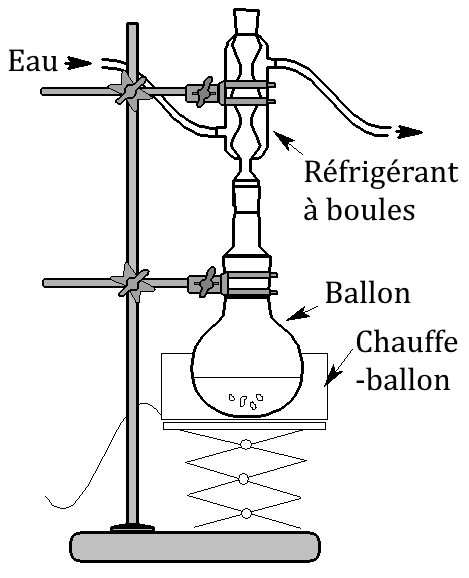
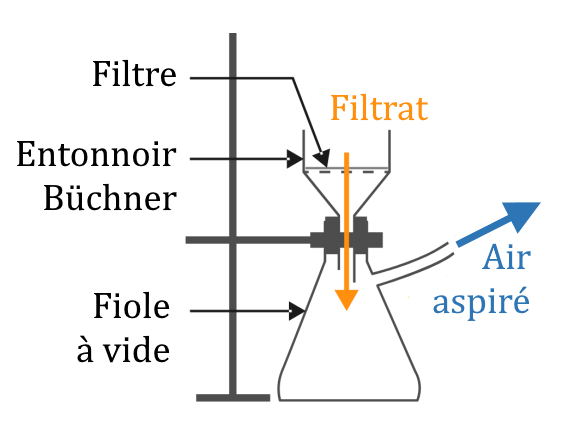
Extraction du produit obtenu
À la fin de chaque étape, on obtient certes le produit désiré, mais il reste également d’autres espèces non souhaitées (réactifs n’ayant pas réagi, solvant, catalyseur, « sous-produit » de la réaction, c’est-à-dire les produits qui ne nous intéresse pas). Il faut donc isoler le produit obtenu.
De nombreuses méthodes existent. Il faut choisir la méthode la plus efficace connaissant les propriétés des espèces chimiques présentes dans le mélange. Il peut s’agir de :
- Filtration
- Distillation fractionnée
- Extraction liquide-liquide (voir chapitre C7)
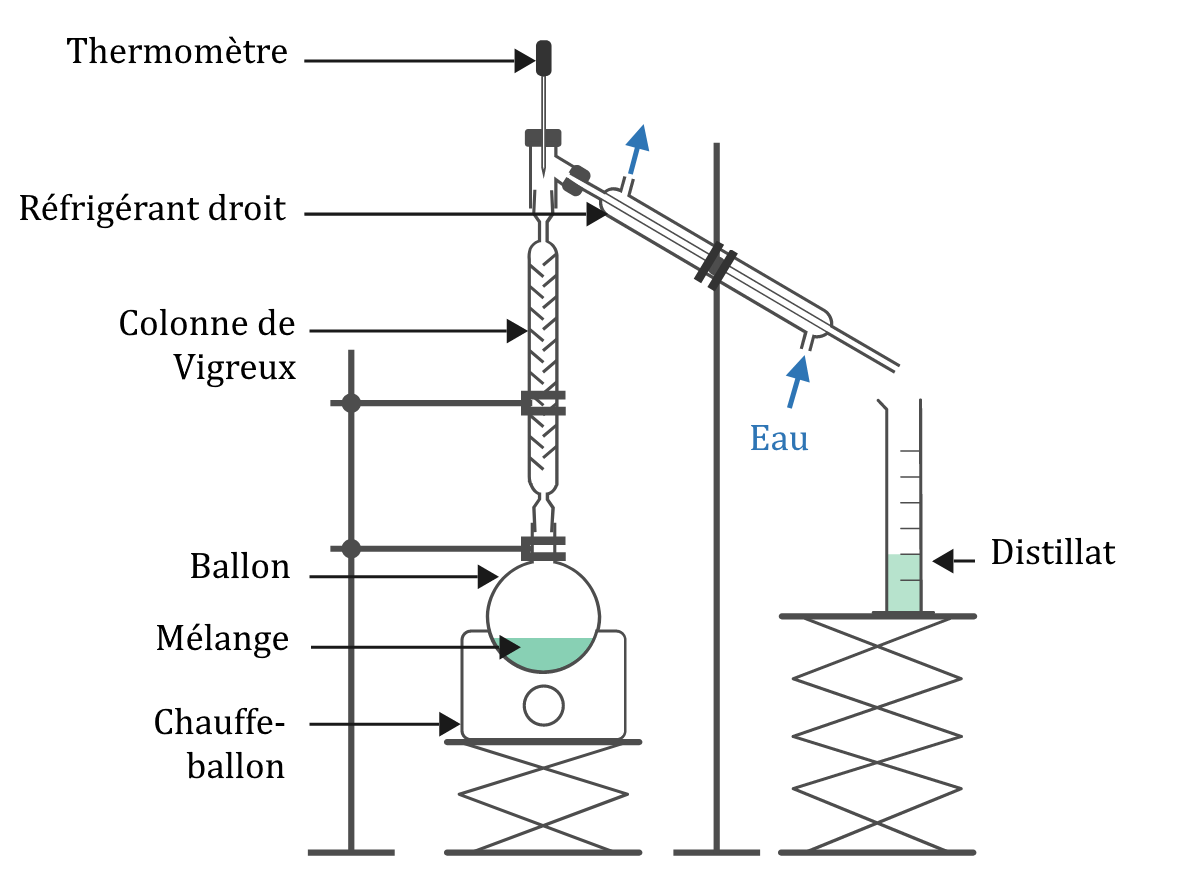
Purification du produit obtenu
Même après l’extraction, il peut rester des traces d’espèces chimiques autres que l’espèce chimique synthétisée. Il faut donc purifier le produit obtenu. Pour cela, plusieurs techniques sont utilisées :
- Recristalisation
- Lavage
- Distillation fractionnée
Ces techniques sont très nombreuses. Vous pouvez jeter un coup d’œil sur cet article Wikipédia pour plus de détails.
Identification du produit obtenu
On peut identifier un produit par mesure de sa température de fusion sur un banc Köfler, par une CCM (chromatographie sur couche mince) et par d’autres techniques encore (spectre IR, mesure de l’indice de réfraction optique, …)
Synthèse du cyclohexanol
Voici des extraits du protocole expérimental de la synthèse du cyclohexanol par réduction de la cyclohexanone :
- dans un ballon, placer la cyclohexanone, l’éthanol et le réducteur en solution aqueuse puis laisser réagir durant 20 minutes ;
- verser ensuite le mélange obtenu dans une ampoule à décanter et extraire la phase aqueuse ;
- réaliser une distillation fractionnée de la phase organique après l’avoir lavée et séchée.
1. Donner les formules de la cyclohexanone et du cyclohexanol.
2. Identifier les étapes de transformation des réactifs, d’isolement, de purification ou d’analyse du produit.
3. Dans quel état physique se trouve, a priori, le cyclohexanol à la fin de la synthèse ?
Correction
Synthèse de l’eugénol
Après une synthèse, on réalise une CCM et on obtient le chromatogramme ci-dessus. Le dépôt A correspond à l’eugénol commercial pur et le dépôt B au produit obtenu.
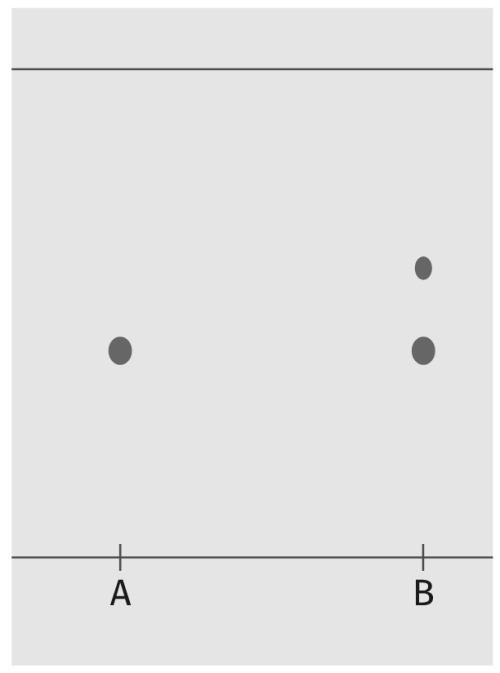
1. La synthèse a-t-elle permis de former de l’eugénol ?
2. Le composé obtenu est-il pur ?
Correction
Première étape de la fabrication d’un savon
Pour réaliser la synthèse d’un savon, on chauffe à reflux pendant 30 min un mélange constitué d’oléine, d’une solution aqueuse d’hydroxyde de sodium concentré (soude), d’éthanol et de quelques grains de pierre ponce. La réaction de l’oléine avec les ions hydroxyde produit du savon.
Après la réaction, on transvase le mélange obtenu dans un bécher contenant de l’eau salée. On filtre ensuite le contenu du bécher.
1. Représenter le schéma du montage utilisé pour la première étape et le légender.
2. Quels sont les deux intérêts d’un tel montage ?
3. Quel est le rôle de l’éthanol ? De la pierre ponce ?
4. Que va-t-il se passer lorsqu’on transvase le mélange dans l’eau salée ?
5. Représenter et légender le schéma du montage utilisé pour la filtration.
| Solubilité | Oléine | Soude | Savon |
|---|---|---|---|
| dans l’eau | insoluble | soluble | soluble |
| dans l’eau salée | insoluble | soluble | insoluble |
| dans l’éthanol | soluble | soluble | partiellement soluble |
Correction
Rendement
- Déterminer, à partir d’un protocole et de données expérimentales, le rendement d’une synthèse.
Le rendement d’une synthèse est la fraction de la qdm de produit obtenu expérimentalement $*n_{exp}*$, divisé par la qdm de produit maximum $*n_\max*$ que l’on pourrait obtenir si on avait atteint l’avancement $*x_\max*$ lors de toutes les étapes.
Si, après avoir réalisé toutes les étapes de cette synthèse, on obtient 0,5 mol d’aspirine pour chaque mole de benzène utilisée, alors le rendement est de 50 %.
Rendement d’une synthèse
On réalise la synthèse de l’acétate d’isoeugénol à partir d’eugénol. L’acétate d’isoeugénol est un solide blanc. L’eugénol est un liquide jaunâtre de densité 1,04.
On a obtenu 11,3 g d’acétate d’isoeugénol à partir de 10 mL d’eugénol. Quel est le rendement de cette synthèse ?
Correction
TP Synthèse de l’aspirine
- Mettre en œuvre un montage à reflux pour synthétiser une espèce chimique organique.
- Isoler, purifier et analyser un produit formé.
Dans ce TP, nous allons réaliser la synthèse (ou plutôt l’hémisynthèse) de l’aspirine, c’est à dire la transformation de l’acide salycilique en aspirine.
L’équation de la réaction est :
Protocole de la synthèse
- Préparer un bain marie à 55 – 60 °C en plaçant un cristallisoir sur un agitateur magnétique chauffant.
- Introduire dans un ballon à fond plat 3,0 g d’acide salicylique et, avec précaution, 6,0 mL d’anhydride éthanoïque (✋ sécurité !).
- Ajouter 3 gouttes d’acide sulfurique concentré (✋ sécurité !).
- Chauffer à reflux 10 à 15 minutes le mélange en maintenant une agitation douce.
- Retirer le bain marie, puis, très progressivement ajouter 50 mL d’eau distillée froide par le haut du réfrigérant.
- Placer ballon dans eau glacée. L’aspirine précipite.
- Filtrer sur Büchner

Protocole de la recristallisation
- Dissoudre les cristaux dans la plus petite quantité possible d’éthanol (✋ 2 ou 3 mL maximum !)
- Après la dissolution, verser de l’eau glacée dans l’erlenmeyer afin que l’aspirine cristallise.
- Après recristallisation, filtrer, laver l’aspirine à l’eau glacée pour ne pas redissoudre ce qui reste
- Essorer sur Büchner
Questions
• Masse molaire de l’anhydride acétique : 102 g·mol-1 ;
• Masse molaire de l’acide salicylique : 138 g·mol-1
1. Quelles sont les quantités initiales de réactifs ?
2. Dresser le tableau d’avancement de la réaction. Quelle est la quantité d’aspirine attendue en fin de réaction ?
3. Comment pourrait-on vérifier la pureté de l’aspirine synthétisée ?
Éléments de réponses
2. Tableau d’avancement
| $*x*$ (mmol) | $*\; \ce{C7H6O3} \; + \; \ce{C4H6O3} \; \rightarrow \; \ce{C9H8O4} \; + \; \ce{C2H4O2}*$ | |||
|---|---|---|---|---|
| 0 | 21,7 | 63,5 | 0 | 0 |
| $*x*$ | 21,7 – $*x*$ | 63,5 – $*x*$ | $*x*$ | $*x*$ |
| $*x_f*$ = 21,7 | 0 | 41,8 | 21,7 | 21,7 |