C3. États de la matière
Vous le savez depuis longtemps, la matière peut se présenter en trois états courants : solide, liquide et gazeux. Nous nous intéresserons dans ce chapitre aux caractéristiques de ces trois états et au passage d’un état vers un autre.
Les trois états de la matière
- Caractériser les différents états de la matière (solide, liquide et gaz).
L’état solide
À l’état solide, les différentes entités constituant la matière (molécules, atomes ou ions), sont liés les uns aux autres.
Ça explique que dans cet état, la matière possède une forme propre. Les entités ne peuvent pas bouger les unes par rapport aux autres.
Les entités vibrent autour de leur position d’équilibre (sauf si on est au « zéro absolu », c’est-à-dire -273 °C).
Plus la température est élevée, plus elles vibrent fort. Si la température est suffisamment élevée, la vibration des entités est suffisamment forte pour que la matière passe à l’état liquide (nous y reviendrons 😊).
L’état liquide
À l’état liquide, les entités sont faiblement liées les unes aux autres. Elles le sont suffisamment pour qu’elles restent en contact, mais pas assez pour les empêcher de glisser les unes contre les autres.
Ceci explique que dans cet état, la matière est presque aussi dense qu’à l’état solide, mais qu’elle ne possède pas de forme propre : elle prend la forme du récipient dans laquelle elle se trouve.
L’état gazeux
Dans cet état, les entités chimiques sont complètement séparées les unes des autres : elles se déplacent trop vite et se rencontrent trop rarement pour rester liées entre elles.
Ceci explique que dans cet état, la matière est beaucoup moins dense qu’à l’état solide ou à l’état liquide, et qu’elle est compressible, c’est-à-dire qu’on peut réduire son volume en excerçant une pression dessus.
En physique, l’état solide et l’état liquide sont appelés des états condensés, car il n’y a quasiment pas d’espaces entre les différentes entités. Ces deux états sont donc incompressibles.
À l’état liquide et à l’état gazeux, on parle de fluide, car dans ces états, la matière peut s’écouler. Elle n’a pas de forme propre.
Changement d’état
- Caractériser les différents changements d’état d’un corps pur.
- Interpréter les changements d’état au niveau microscopique.
- Changements d’états de la matière.
- Conservation de la masse, variation du volume, température de changement d’état.
Noms des changement d’état
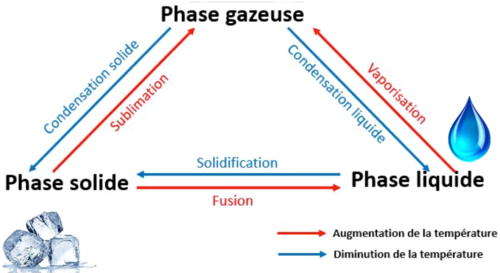
Conditions pour un changement d’état
Un changement d’état peut se produire lorsque la température et/ou la pression de la matière change.
Eh bien c’est très variable. Ça dépend de la matière. Et la température de changement d’état dépend de la pression. 😅
Exemple de l’eau
Vous savez tous que l’eau passe de l’état solide à l’état liquide (ou inversement) à 0 °C. Et qu’elle passe de l’état liquide à l’état gazeux (ou inversement) à 100 °C. Mais ce n’est pas toujours vrai ! 😮
Ça dépend aussi de la pression ! Ces valeurs de température ne sont vraies que si l’eau est à la pression atmosphérique au niveau de la mer (1013 hPa).
Vous pouvez très bien avoir de l’eau bouillante à… 20 °C – si la pression est suffisamment faible. De même, vous pouvez très bien avoir de l’eau liquide à 200 °C – si la pression est suffisamment forte.
Les états de l’eau
Pour prévoir dans quel état se trouve de l’eau, il faut connaître à la fois les conditions de température et de pression. Pour cela, il faut utiliser le graphique ci-dessous.
On prend un bloc de glace à 0 °C et une pression de une atmosphère (1 atm).
1.a Que se passe-t-il si la pression augmente sans que la température ne change ?
1.b Que se passe-t-il si la pression diminue ?
2.La pression atmosphérique sur Mars est de 0,006 atm. La température sur Mars peut monter jusqu’à 20 °C. Dans ces conditions, l’eau peut-elle se trouver à l’état liquide sur Mars ?
Correction
TP Quelques aspects des changements d’état
- Proposer et mettre en œuvre un protocole expérimental pour étudier les propriétés des changements d’état.
Objectifs
- mettre en évidence l’influence de la pression sur la température d’ébullition de l’eau (expérience professeur) ;
- déterminer la masse volumique de la glace.
Déterminer la masse volumique de la glace
Nous avons déjà vu comment mesurer précisément le volume d’un solide. Mais ici, c’est délicat. Si on plonge un morceau de glace dans l’eau, il va fondre… 😊. On doit donc faire autrement.
Pour cela, comme les fêtes approchent, nous allons utiliser de l’éthanol et les données ci-dessous.
Données
- La masse volumique de l’éthanol pur à 20 °C est de 0,79 g·mL-1 à 20 °C
- L’eau a une masse volumique de 1,00 g
- L’eau et l’éthanol sont miscibles en toutes proportions
- Un mélange d’eau et d’éthanol a une densité qui dépend de la proportion de chacun des liquides
Titre volumique en alcool (%) masse volumique (g·mL-1) 100 0,79 95 0,81 90 0,83 80 0,86 70 0,89 60 0,91 50 0,93 40 0,95 30 0,96 20 0,97
Travail demandé
Vous disposez d’un solution hydroalcoolique dont le titre volumique est de 70 % en éthanol.
- Réaliser une première expérience permettant de déterminer si la masse volumique de la glace est supérieure ou inférieure à 0,89 g·mL-1.
- Réaliser d’autres expériences permettant de donner un encadrement de la masse volumique de la glace.
Éléments de réponses
La difficulté ici est que la méthode vue au chapitre C1 est difficilement applicable ici. La glace fond lorsqu’elle est immergée dans l’eau. On va adopté ici une autre stratégie : la masse volumique de la glace sera déterminée en la plaçant dans différentes solutions de densité variable et en vérifiant si la glace coule ou flotte dans ces différentes solutions.
En réalisant successivement plusieurs mélanges eau-éthanol, on trouve que le glaçon coule encore dans un mélange eau-éthanol à 56 % en éthanol, mais il flotte dans un mélange à 49 % en éthanol
On peut en déduire que la masse volumique de la glace est comprise entre 0,91 et 0,93 g·mL-1.
La valeur exacte est de 0,917 g·mL-1 à 0 °C.
Propriétés des changements d’état
- Lors d’un changement d’état, la masse d’une substance ne change pas, mais son volume peut varier (vous avez vu cela dans les classes antérieures).
- Pour un corps pur, la température de changement d’état est constante au cours du changement. Cette température dépend de la pression et de la nature du corps pur.
- La température de changement d’état d’un mélange dépend de sa composition. Celle-ci peut varier au cours du changement d’état.
Deux exemples avec l’eau salée
Lorsqu’on souhaite faire fondre la neige sur la route, on y répand du sel. Pourquoi ? Parce que le sel, lorsqu’il se mélange à l’eau, fait baisser son point de fusion. Plus l’eau contient de sel, plus sa température de fusion sera basse.
De la même manière, lorsqu’on fait bouillir de l’eau salée pour les pâtes, sa température d’ébullition n’est pas de 100 °C, mais un peu plus (ça dépend de la quantité de sel que l’on a dissous dans l’eau).

Changements d’état et mélanges

Document : formation de la banquise
La banquise est l’étendue de glace qui se forme à la surface de la mer. Elle se forme durant l’hiver polaire, lorsque la température de l’eau de mer descend en dessous de −1,8 °C. Au cœur de l’hiver, l'épaisseur des glaces peut atteindre 1 à 2 mètres, sans compter la neige qui s’y accumule.
À la fin de l’été, le froid polaire s’installe, parfois brutalement (−40 °C) ; la surface de l’océan se refroidit mais en raison des mouvements de la mer (houle, vagues, etc.), la glace de mer ne prend pas d’un seul coup. Quand la température de l’eau atteint −1,86 °C, les premières paillettes de glace cristallisent.
Source : Wikipédia
1. Expliquer pourquoi il faut une température inférieure à 0 °C pour que la banquise se forme.

Document : liquide de refroidissement
Le moteur d’un véhicule thermique génère une chaleur importante qui, si elle n'est pas contrôlée, peut causer de graves dommages. Celui-ci est refroidit par un système utilisant du liquide de refroidissement, qui est un mélange d’eau et d’éthylène glycol, souvent appelé « antigel ». Celui-ci abaisse le point de congélation* de l'eau et augmente son point d'ébullition*.
La température de fusion d’un mélange eau - éthylène glycol à 40 % en volume d’éthylène glycol est de –26 °C.
* dans ce contexte, le mot point est synonyme de température
2.a. Expliquer pourquoi l’ajout d’éthylène glycol dans l’eau modifie sa température d’ébullition et sa température de fusion.
2.b. Quel est l’intérêt de l’utilisation d’un liquide de refroidissement plutôt que de l’eau pure ?
2.c. Pourquoi ne pas utiliser de l’eau salée à la place du liquide de refroidissement ?