C4. Transformation de la matière
La matière est constituée d’espèces chimiques. Dans certaines conditions, ces espèces chimiques peuvent se transformer pour donner d’autres espèces chimiques. C’est ce qu’on appelle une transformation chimique.
Transformation chimique
- Distinguer transformation chimique et mélange, transformation chimique et transformation physique.
- Interpréter une transformation chimique comme une redistribution des atomes.
- Conservation de la masse lors d’une transformation chimique.
- Utiliser une équation de réaction chimique fournie pour décrire une transformation chimique observée
Espèces chimiques
On a vu au chapitre C1 ce qu’était une espèce chimique. Je le rappelle brièvement ci-dessous.
Une espèce chimique est :
- soit, le plus souvent une molécule, c’est-à-dire un groupe d’atomes liés entre eux par des liaisons atomiques et qui ne porte aucune charge, par exemple $*\ce{H2O}*$ ou $*\ce{CO2}*$ ;
- soit un atome seul qui n’est pas lié d’autres atomes comme dans une molécule, par exemple les gaz appelés gaz nobles comme $*\ce{Ne}*$ ou encore les métaux comme $*\ce{Fe}*$ ;
- soit un ion, c’est-à-dire un atome ou une molécule ayant perdu ou gagné un ou plusieurs électrons, par exemple $*\ce{Cl-}*$ ou $*\ce{NH4^+}*$.
Transformations
Il y a plusieurs types de transformation de la matière. Toutes ne sont pas des transformations chimiques.
Mélange
Lorsqu’on dissout du « sucre de cuisine » (qu’on appelle en chimie saccharose – parce qu’il existe en fait plein de sucres différents) ($*\ce{C12H22O11}*$) dans l’eau, par exemple, il y a bien une transformation. Le sucre passe de l’état solide à l’état « dissous dans l’eau ».
Mais il ne s’agit pas d’une transformation chimique car les molécules de saccharose et les molécules d’eau sont toujours là. Aucune des espèces chimiques présentes avant le mélange n’a changé.
Changement d’état physique
Lorsqu’on change l’état physique d’une espèce chimique (par exemple lorsque de la glace d’eau fond pour devenir de l’eau liquide), il s’agit aussi d’une transformation. Mais c’est une transformation physique, pas une transformation chimique, car l’espèce chimique $*\ce{H2O}*$ n’a pas changé au cours de cette transformation.
Transformation chimique
Vous l’aurez compris avec les deux paragraphes précédents, voici la définition d’une transformation chimique :
Les atomes ne disparaissent pas au cours d’une transformation chimique. C’est un peu comme jouer au légo : vous avez au début une ou plusieurs constructions faites de différentes pièces de légo (les espèces chimiques de départ), et avec ces mêmes pièces, vous fabriquez de nouvelles constructions (les espèces chimiques obtenus après la transformation).
Il y a les mêmes pièces avant et après avoir transformé vos constructions.
Eh bien au cours d’une transformation chimique, il y a le même nombre d’atomes de chaque élément avant et après la transformation chimique.
Transformations
Parmi les transformations ci-dessous, indiquer, en justifiant, celles qui pourraient être des transformations chimiques.
- La transformation de la neige en glace lors de la formation de glaciers dans les montagnes.
- La formation de rouille (mélange de $*\ce{Fe(OH)3}*$ et $*\ce{ Fe2O3}*$) lorsque du fer $*\ce{Fe}*$ est exposé à de l’air humide
- La solidification de l’huile d’olive lorsqu’elle est exposée au froid
- La décomposition du peroxyde d’hydrogène $*\ce{H2O2}*$ en eau et en dioxygène
- La formation de bronze lorsqu’on mélange du cuivre et de l’étain (rechercher sur internet ce qu’est le bronze)
Correction
- La transformation de la neige en glace est simplement un compactage de la neige. L’espèce chimique impliquée (l’eau) reste inchangée au cours de cette transformation.
- On a au départ du fer (Fe) et de l’air humide (donc contenant $*\ce{H2O}*$ et $*\ce{O2}*$). Ceci conduit à la formation d’un mélange de $*\ce{Fe(OH)3}*$ et de $*\ce{ Fe2O3}*$. Les espèces chimiques impliquées se sont donc transformées. Il s’agit bien d’une transformation chimique.
- C’est un changement d’état (solidification). Pas une transformation chimique. Il suffit de réchauffer l’huile pour lui rendre son aspect « habituel ».
- C’est une transformation chimique car l’espèce de départ ($*\ce{H2O}*$2) est différentes des espèces obtenus après transformation ($*\ce{H2O}*$ et $*\ce{O2}*$).
- Le bronze est un alliage de cuivre et d’étain. Il s’agit d’un simple mélange. Ce n’est pas une transformation chimique.
Conservation de la masse
Puisqu’au cours d’une réaction chimique, aucun atome ne disparaît et aucun atome n’apparaît, ça signifie que la masse des réactifs est égale à la masse des produits.
Équation-bilan d’une transformation chimique
- Utiliser une équation de réaction chimique fournie pour décrire une transformation chimique observée
- Conservation de la masse lors d’une transformation chimique
Une équation-bilan est une manière de représenter ce qui se passe lors d’une transformation chimique. Par exemple, lorsqu’on brûle du méthane $*\ce{CH4}*$, celui-ci réagit avec le dioxygène pour donner du dioxyde de carbone $*\ce{CO2}*$ et de l’eau. Cette transformation est représentée par son équation-bilan : $µ \ce{CH4 + 2O2 → CO2 + 2H2O} µ$ Cette équation-bilan se lit comme ceci : une molécule de méthane réagit avec deux molécules de dioxygène pour donner une molécule de dioxyde de carbone et deux molécules d’eau.
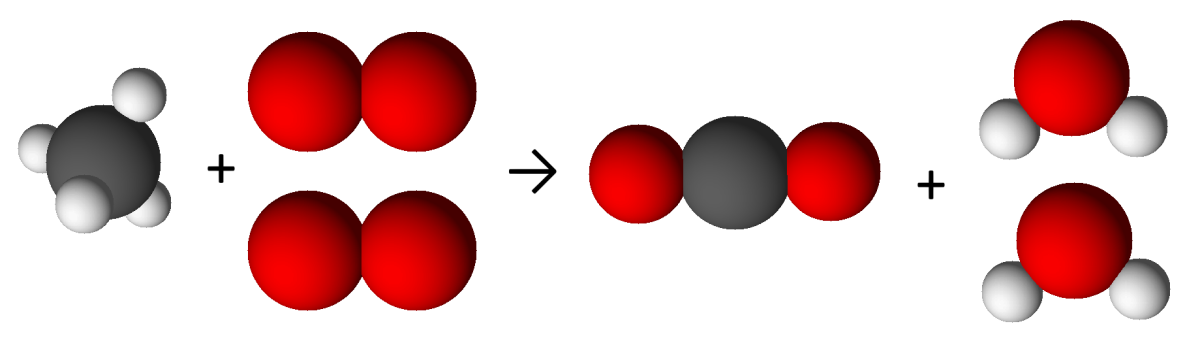
Le méthane et le dioxygène sont appelés des réactifs. L’eau et le dioxyde de carbone sont des produits de la réaction. Dans l’exercice suivant, on va analyser l’écriture de cette équation-bilan, notamment la raison d’être du 2 devant $*\ce{O2}*$ et $*\ce{H2O}*$.
Analyse d’une équation-bilan
Reprenons l’exemple ci-dessus de la combustion du méthane : $µ \ce{CH4 + 2O2 → CO2 + 2H2O} µ$
1. Combien y a-t-il d’atomes de chaque élément dans les réactifs ? Et dans les produits ? Qu’est-ce que cela montre ?
2. Pourquoi faut-il deux molécules de $*\ce{O2}*$ pour chaque molécule de méthane ?
Prenons un exemple un peu plus complexe : le combustion du propane $*\ce{C3H8}*$ dans le dioxygène. Cette réaction produit également du dioxyde de carbone et de l’eau.
3. Trouver l’équation-bilan de la réaction. Cette équation-bilan doit respecter le fait qu’il y a autant d’atomes de chaque élément côté réactif et côté produit.
Correction
1. Dans les réactifs comme dans les produits, il y a 1 atome de carbone, 4 atomes d’hydrogène et 4 atomes d’oxygène. Cela montre qu’on a autant d’éléments de chaque type avant et après la réaction. Cette « loi » s’appelle la loi de conservation des éléments.
2. Il faut assez d’atomes d’oxygène pour former deux molécules d’eau (car il y a 4 atomes d’hydrogène à « réutiliser ») et une molécule de dioxyde de carbone. Il faut donc 4 atomes d’oxygène, c’est-à-dire deux molécules de dioxygène.
3. $* \ce{C3H8} + \ce{5O2} → \ce{3CO2} + 4 \ce{H2O} *$
TP Réaction du fer avec l’acide chlorhydrique
- Identifier expérimentalement une transformation chimique
Objectif : étudier la réaction chimique entre le fer métallique et l’acide chlorhydrique.
La plupart des métaux sont sensibles à l’action des acides. Les acides sont des espèces chimiques qui, lorsqu’ils sont en solution, produisent des ions oxonium $*\ce{H3O+}*$. Ces ions sont capables de réagir avec la plupart des métaux pour les transformer en ions.
Expérience n°1
Matériel disponible
- De l’acide chlorhydrique relativement concentré, qui est une solution aqueuse d’ions $*\ce{H3O+}*$ et $*\ce{C\ell^-}*$
- Pipette en plastique
- De la limaille de fer
- Tube à essai
- Dispositif pour récupérer le gaz produit par la réaction
- Mettre un peu de limaille de fer dans un tube à essai
- Verser, à l’aide d’une pipette, de l’acide chlorhydrique sur la limaille
- Boucher le tube à essai et récupérer le gaz qui se dégage dans un autre tube à essai, par déplacement d’eau
Question
1. Quelles observations laissent penser qu’il y a probablement une réaction chimique ?
Expérience n°2
- Approcher une allumette du tube à essai qui a recueilli le gaz produit, en le gardant orienté à l’envers (ouverture du tube vers le bas).
- Mettre de la soude dans le tube où s’est déroulé la réaction.
Questions
2. Que se passe-t-il lorsque le gaz est mis en contact de la flamme ? Ceci est caractéristique du dihydrogène $*\ce{H2}*$.
3. Que se passe-t-il lorsqu’on vers la soude sur le mélange réactionnel ? Cette couleur verdâtree est caractéristique des ions $*\ce{Fe^2+}*$
4. À partir de vos observations, proposer une équation-bilan qui permet d’expliquer ce que l’on a observé au cours de ces expériences.
Éléments de réponses
Équilibrer des équations-bilans
Proposer une équation-bilan pour les transformations chimiques décrites ci-dessous.
1. L’éthanol $*\ce{C2H6O}*$ réagit avec le dioxygène pour donner de l’acide éthanoïque $*\ce{C2H4O2}*$ et de l’eau.
2. Le zinc ($*\ce{Zn}*$) réagit avec l’acide chlorhydrique ($*\ce{H3O+}*$ ; $*\ce{C\ell^-}*$) pour donner des ions zinc $*\ce{Zn^2+}*$, du dihydrogène et de l’eau. L’ion chlorure $*\ce{C\ell^-}*$ est un ion spectateur (il est présent mais il ne réagit pas. Donc on ne le met pas dans l’équation-bilan).
Correction
Commencez d’abord par repérer les réactifs et les produits dans l’énoncé. Écrivez-les dans l’équation-bilan sans chercher à les équilibrer. Une fois que c’est fait, équilibrez votre équation-bilan.
1. $* \ce{C2H6O + O2 → C2H4O2 + H2O} *$. Celle-ci est simple car elle est tout de suite équilibrée.
2. $* \ce{Zn + 2H3O+ → Zn^2+ + H2 + 2H2O} *$
Corrosion d’un métal
- Réactions de corrosion d’un métal
La corrosion d’un métal correspond à sa réaction avec une espèce chimique capable de le faire passer de l’état atomique à l’état ionique. Dans l’air, les espèces chimiques capable de provoquer la corrosion des métaux sont le dioxygène de l’air et, l’ion $*\ce{H^+}*$ fourni par l’eau ou par des polluants. L’eau est parfois nécessaire pour qu’une réaction de corrosion ait lieu.
Lors d’une corrosion, le métal passe de l’état atomique à l’état ionique. Il donne un ou plusieurs électrons aux atomes d’oxygène avec qui il réagit. Il se forme alors un oxyde métallique dont la formule peut être plus ou moins complexe selon le métal.
Le cas le plus connu est bien sûr l’oxyde de fer, connu sous le nom de rouille. Il s’agit d’un mélange complexe composé d’ions fer III ($*\ce{Fe^3+}*$), d’ions hydroxyde ($*\ce{HO-}*$) et d’ions oxyde ($*\ce{O^2-}*$).

Mais le fer n’est pas le seul métal qui s’oxyde en présence d’air. L’aluminium et le zinc, par exemple, s’oxydent eux aussi. La couche d’oxyde se présente alors sous la forme d’un dépot terne à la surface du métal.
L’argent également peut s’oxyder lorsqu’il est exposé à l’air. Il se forme une couche d’oxyde d’argent $*\ce{Ag2O}*$ noire à la surface du métal.
Le cuivre se recouvre d’une couche de vert-de-gris, que l’on remarque sur le toit de certains bâtiments ou sur certaines statues (notamment la statute de la Liberté).

La couche d’oxyde formée sur un métal suite à sa corrosion joue un rôle protecteur : elle isole le métal du contact avec l’air et la corrosion s’arrête naturellement. C’est le cas de tous les métaux… sauf le fer. Lors de la corrosion du fer, la rouille rend le métal poreux. Elle permet à l’air et à l’humidité de pénétrer dans le métal et cela amplifie le phénomène de corrosion. Une fois qu’un morceau de fer rouille, sa corrosion s’accélère.
Il existe bien sûr différentes solutions pour ralentir la corrosion du fer. La première consiste à y déposer une couche de vernis ou de peinture, pour l’isoler du contact avec l’air. On peut également ajouter d’autres éléments chimiques (notamment le chrome), en petite quantité, pour obtenir un alliage plus résistant à la corrosion. L’« inox », avec lequel on fait des couverts ou des éviers, est un exemple d’un tel alliage.
Oxydation des métaux
1. Donner l’équation-bilan de la corrosion de l’argent ($*\ce{Ag}*$) en oxyde d’argent ($*\ce{Ag2O}*$) en présence d’air.
2. Donner l’équation-bilan de la formation de l’alumine ($*\ce{Al2O3}*$) lorsque l’aluminium ($*\ce{Al}*$) est exposé au dioxygène de l’air
3. Certains astéroïdes sont composés presque exclusivement de fer. Pourquoi ne rouillent-ils pas tant qu’ils restent dans l’espace ?