C7. Piles & électrolyseurs
Les piles sont des dispositifs où deux réactifs réagissent par une réaction spontanée d’oxydoréduction sans être en contact direct (c’est là toute l’astuce de la pile). Les électrolyseurs sont des dispositifs permettant de faire réagir deux espèces par une réaction non spontanée d’oxydoréduction, grâce à un apport d’énergie électrique. Ces deux dispositifs sont omniprésents dans notre vie quotidienne et le seront encore davantage avec l’objectif mondial de la neutralité carbone.
Pour bien suivre ce chapitre, vous devez être au point sur le chapitre C4 de première traitant des réactions d’oxydoréduction.
Oxydants & réducteurs usuels
- Citer des oxydants et des réducteurs usuels : eau de Javel, dioxygène, dichlore, acide ascorbique, dihydrogène, métaux.
- Justifier le caractère réducteur des métaux du bloc s.
Le caractère plus ou moins oxydant d’une espèce chimique est dû à sa tendance plus ou moins marquée à capter des électrons. Cette tendance dépend de la présence, dans l’espèce chimique, d’éléments électronégatifs qui ne peuvent pas « satisfaire » leur tendance à attirer des électrons à eux.
L’oxygène, par exemple, est un élément très électronégatif. Dans la molécule d’eau, l’oxygène est lié à deux hydrogène. Comme l’électronégativité de ces derniers est plutôt faible, l’oxygène de la molécule attire à lui les électrons des hydrogène impliqués dans les liaisons covalentes. Pour parler de manière imagée, l’électronégativité de l’oxygène, dans ce cas, est « satisfaite ».
Mais dans la molécule de dioxygène, c’est une autre histoire : les deux oxygène sont liés entre eux et ils ne peuvent pas « satisfaire » leur électronégativité. Donc ils vont avoir tendance à réagir avec d’autres espèces chimiques pour leur prendre des électrons.
Un autre oxydant assez puissant que vous connaissez bien est l’ion permanganate $*\ce{MnO4^-}*$.
Pour les espèces réductrices, l’explication est la même, sauf que ces espèces cèdent plus ou moins facilement des électrons.
Métaux du bloc s
Le bloc s est constitué des deux premières colonnes du tableau périodique. Les éléments qui s’y trouvent sont tous des métaux – bien que l’hydrogène, qui pourrait se comporter comme un métal à très haute pression (même si expérimentalement il y a encore beaucoup de débats, voir Wikipédia) – ait une place à part.
Ces métaux sont fortement réducteurs car, pour avoir leur couche externe saturée – et donc gagner en stabilité énergétique – ils doivent céder un ou deux électrons.
Le sodium, par exemple réagit très rapidement avec l’eau. La réaction peut être tellement rapide qu’elle peut être explosive.
Pile
- Justifier la stratégie de séparation des réactifs dans deux demi-piles et l’utilisation d’un pont salin.
- Modéliser et schématiser, à partir de résultats expérimentaux, le fonctionnement d’une pile.
- Déterminer la capacité électrique d’une pile à partir de sa constitution initiale.
Réalisation d’une pile
- Illustrer un transfert spontané d’électrons par contact entre réactifs et par l’intermédiaire d’un circuit extérieur.
- Réaliser une pile, déterminer sa tension à vide et la polarité des électrodes, identifier la transformation mise en jeu, illustrer le rôle du pont salin.
- Réaliser une pile
Objectif : découvrir le principe de la pile électrique
Transfert d’électrons entre réactifs
• Plonger quelques minutes une lame de zinc dans une solution de sulfate de cuivre $*\ce{(Cu^2+ + SO4^2-)}*$ et inversement, plonger une lame de cuivre dans une solution de sulfate de zinc $*\ce{(Zn^2+ + SO4^2-)}*$. Observer.
Quelles hypothèses pourrait-on faire ? Peut-on en vérifier quelques unes ?
Séparation des réactifs
L’idée, dans une pile, c’est de ne pas mettre les réactifs en contact direct, mais de les forces à échanger des électrons… à travers un circuit. De cette manière, on peut récupérer une partie de l’énergie chimique libérée sous forme d’énergie électrique pour en faire ce qu’on veut.
• Proposer une solution pour y arriver.
Principe de fonctionnement
Une pile est un dispositif où se déroule une réaction spontanée d’oxydoréduction entre deux réactifs lorsque la pile fournit un courant.
Sa structure permet que l’échange d’électrons entre les deux réactifs ne soit pas direct (c’est l’essence même du principe de la pile !), mais qu’il ne puisse se faire lorsqu’il y a un contact électrique entre ses deux électrodes (anode et cathode).
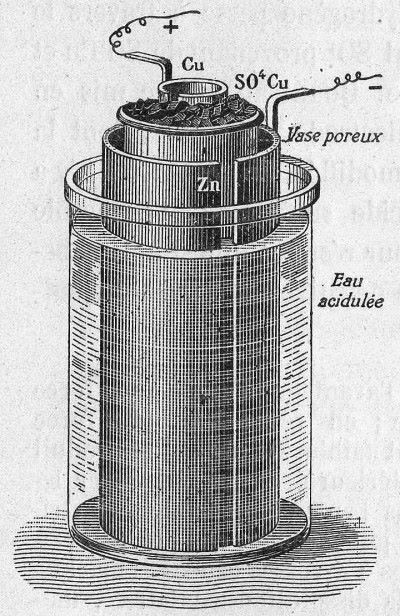
Les électrodes sont des conducteurs solides qui assurent le contact électrique avec les réactifs. Elles peuvent être constitué d’un des réactifs lorsque celui-ci est un métal (si l’un des réactifs est du cuivre, par exemple) ou de carbone graphite (conducteur chimiquement relativement inerte). Les demi-équations d’oxydoréduction se déroulent au contact de ces électrodes.
La borne positive de la pile est celle où entrent les électrons. Il s’y déroule donc une oxydation lors de sa décharge. La borne négative est celle d’où sortent les électrons. Il s’y déroule donc une réduction lors de sa décharge.
À l’intérieur de la pile, le passage du courant entre les deux compartiments contenant les deux réactifs est assuré par des ions, à travers, par exemple, un pont ionique, ou une séparation poreuse telle qu’une membrane. Cet échange d’ions est essentiel, car il assure l’électroneutralité de chaque compartiment de la pile. Sans lui, la pile ne fonctionne pas.
La pile Daniell
La pile Daniell (aussi appelée pile zinc-cuivre) a un intérêt historique : il s’agit de la première pile a avoir été utilisée pour des applications techniques (télégraphe).
Elle est simple à réaliser, mais elle n’est plus utilisée à cause du fait que, malgré son coût élevée dû à la présence de cuivre, elle ne peut pas être rechargée.
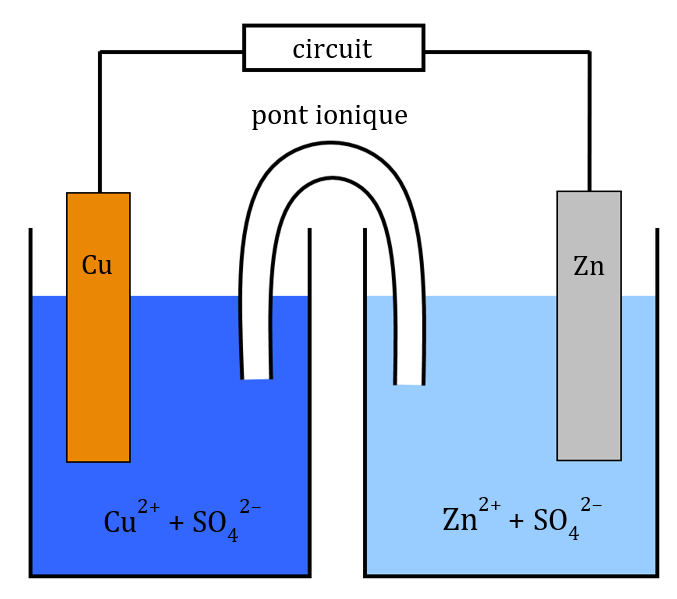
Lors de son fonctionnement la réaction se déroulant à ses électrodes est : $µ\ce{Cu^2+ + Zn \rightarrow Cu + Zn^2+}µ$
Les atomes de zinc constituant l’électrode cèdent chacun deux électrons aux ions cuivre (II). Ces électrons ne peuvent se déplacer que si les deux électrodes sont reliées par un conducteur : lorsque la pile n’est pas connectée à un circuit, elle ne se décharge pas.
La tension à vide de cette pile (c’est-à-dire la tension quand la pile ne fournit aucun courant – rappelez-vous le chapitre P4 de première) est de l’ordre de 1,1 V.
Caractéristiques d’une pile
Tension à vide
La tension à vide d’une pile dépend essentiellement des réactifs utilisés (et dans une bien moindre mesure, de la quantité de réactifs restant et de produits formés).
La pile au lithium, par exemple, ont une tension à vide de l’ordre de 3,7 V, qui est une tension à vide très élevée pour une pile unique.
Si une tension plus élevée est nécessaire (par exemple 12 V), l’astuce consiste à associer plusieurs piles en série (on obtient alors une batterie de piles).
Capacité
La capacité d’une pile, c’est-à-dire la charge totale qu’elle peut débiter avant de se vider, est directement liée à la quantité de réactif qu’elle contient, bien évidemment.
Par exemple, une pile Daniell contenant une mole d’ions $*\ce{Cu^2+}*$ et une mole de $*\ce{Zn}*$ pourra transférer 2 moles d’électrons entre son pôle ⊖ et son pôle ⊕. Sachant qu’une mole d’électrons a une charge de 96,5 kC, elle pourra donc fournir une charge de 96,5×2 kC.
Rappels
Il faut être bien au clair sur les notions suivantes :
- Un courant électrique est un débit de charge
- 1 A = 1 C·s-1
- 1 mol d’électrons a une charge de 96,5 kC (c’est ce qu’on appelle la constante de Faraday : ℱ = 96,5 kC·mol-1
- Une charge peut être exprimée en A·h (ampère-heure). Il s’agit de la charge débitée par un courant de 1 A pendant 1 heure.
Ces notions vont vous permettre de faire le lien entre courant et qdm dans un pile.
Accumulateur au plomb
L’accumulateur au plomb est très utilisé (notamment dans les véhicules à moteur thermique) car il est robuste, résistant au froid, peu coûteux et peut subir un grand nombre de cycles de charge et décharge avant de se détériorer.
Il est par contre polluant (le plomb est un métal toxique) et sa densité énergétique massique (l’énergie stockée par kilogramme de batterie) est bien plus faible que pour les batteries au lithium.
Un accumulateur au plomb fait intervenir les couples oxydant/réducteur suivants : $*\ce{PbO2(s)}*$/$*\ce{Pb^2+(aq)}*$ et $*\ce{Pb^2+(aq)}*$/$*\ce{Pb(s)}*$. L’anode de cet accumulateur est en plomb métallique ($*\ce{Pb}*$) et lorsqu’il est chargé, sa cathode est recouverte d’un dépôt de $*\ce{PbO2(s)}*$. Les réactifs sont donc $*\ce{Pb}*$ et $*\ce{PbO2}*$.
1.a. Quel type de « demi-réaction » a-t-on à l’anode (oxydation ou réduction) ? En déduire la demi-équation de la demi-réaction s’y déroulant (préciser son sens).
1.b. Même question pour la cathode.
2. Écrire l’équation de la réaction d’oxydoréduction de fonctionnement de cet accumulateur.
3. L’anode en plomb est-elle le pôle positif ou négatif de cet accumulateur ? Justifier votre réponse.
4. Une batterie de voiture typique a une capacité de 90 A·h. Donner la masse minimale de $*\ce{PbO2}*$ que doit contenir la batterie lorsqu’elle est complètement chargée.
Correction
1.a. anode = plomb. $*\ce{Pb \rightarrow Pb^2+ + 2e^-}*$. Le plomb perd des électrons, il s’agit donc d’une oxydation.
1.b. $*\ce{PbO2 + 2e^- + 4 H^+ \rightarrow Pb^2+ + 2H2O}*$. Il s’agit donc d’une réduction.
2. $*\ce{PbO2 + Pb + 4 H^+ \rightarrow 2 Pb^2+ + 2H2O}*$.
3. Les électrons rentrent dans le pôle positif. Donc le réactif qui accepte les électrons se trouve au pôle positif. Or le plomb, cède des électrons. Donc le plomb se trouve à la borne négative.
4. 90 A·h = 90×3600 C = 324 kC
Or une mole d’électrons possède une charge de 96,5 kC, donc 324 kC représentent environ 324÷96,5 ≃ 3,36 mol d’électrons.
1 mol de $*\ce{PbO2}*$ réagit avec 2 mol d’électrons. Donc on a besoin de 3,36÷2 = 1,68 mol de $*\ce{PbO2}*$.
$*M(\ce{PbO2})*$ = 207,2 + 16×2 = 239,2 g·mol-1.
Donc il faut $*m*$ = 239,2×1,68 = 401,86 g
Soit 0,40 kg (2 chiffres significatifs) ou encore 4,0·102 g
Pile saline
• Couples rédox impliqués dans la pile saline : $*\ce{Zn^2+}*$/$*\ce{Zn}*$ ; $*\ce{MnO2}*$/$*\ce{MnO2H}*$
Le document ci-dessous représente le schéma en coupe d’une pile saline (aussi appelée pile Leclanché). Les réactifs mis en jeu dans cette pile sont le zinc métallique $*\ce{Zn(s)}*$ et l’oxyde de manganèse $*\ce{MnO2}*$.
Le carbone a un rôle de conducteur des électrons et les ions ammonium $*\ce{NH4+}*$ apportent les ions $*\ce{H+}*$ nécessaires à la réaction de fonctionnement.
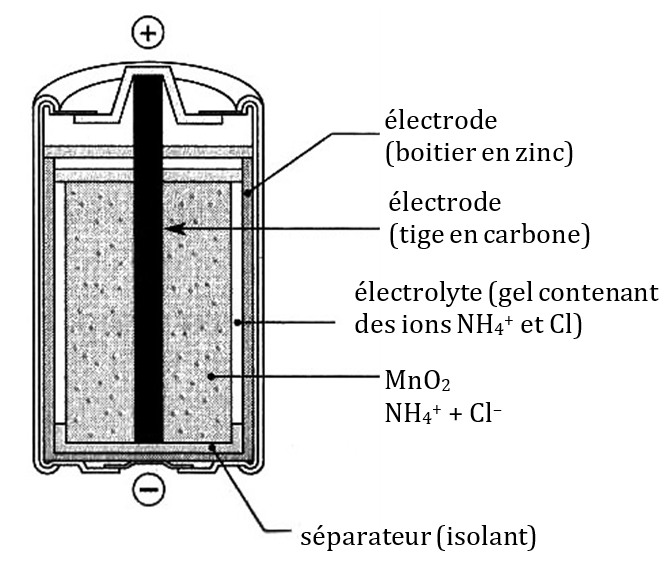
1. Écrire les demi-équations rédox se produisant à chacune des électrodes.
2. En déduire l’équation-bilan de la réaction de fonctionnement de la pile.
3. Quelle électrode est la borne positive de la pile ? Justifier.
4. Quelle partie de la pile joue ici le rôle de pont ionique ?
5.a. Une pile contient 1,0 g d’oxyde de manganèse. On souhaite que, après la réaction complète de $*\ce{MnO2}*$ avec le zinc, la masse de zinc n’ait pas diminué de plus de 10 %.
Montrer que la pile doit contenir au minimum environ 3,8 g de zinc pour respecter ces conditions.
5.b. Quelle est la capacité de cette pile ? Exprimer le résultat en A·h.
Correction
1. $*\ce{Zn \rightarrow Zn^2+ + 2 e^-}*$
$*\ce{MnO2 + H^+ + e^- \rightarrow MnO2H}*$
2. $*\ce{Zn + 2 MnO2 + 2 H^+ \rightarrow Zn^2+ + 2 MnO2H}*$
3. C’est l’électrode en carbone car les électrons rentrent dans la borne positive.
4. C’est l’électrolyte.
5.a. qdm de $*\ce{MnO2}*$ = 1÷87 ≃ 11,5 mmol
Il faut donc 6,0 mmol de $*\ce{Zn}*$ soit 65,4×0,0058 ≃ 0,38 g
5.b. 12 mmol de $*\ce{MnO2}*$ captent 12 mmol d’électrons.
12 mmol d’électrons ont une charge de 0,012×96,5 = 1,16 kC
Soit 1,16·103÷3600 = 0,32 A·h.
Électrolyse
- Modéliser et schématiser, à partir de résultats expérimentaux, les transferts d’électrons aux électrodes par des réactions électrochimiques.
- Déterminer les variations de quantité de matière à partir de la durée de l’électrolyse et de la valeur de l’intensité du courant.
- Citer des exemples de dispositifs mettant en jeu des conversions et stockages d’énergie chimique (piles, accumulateurs, organismes chlorophylliens) et les enjeux sociétaux associés.
TP Réalisation d’une électrolyse
- Réaliser un circuit électrique intégrant un électrolyseur.
- Identifier les produits formés lors du passage forcé d’un courant dans un électrolyseur. Relier la durée, l’intensité du courant et les quantités de matière de produits formés.
Objectif : réaliser une électrolyse, identifier les produits formés et calculer le rendement de l’électrolyse
Réalisation du circuit d’électrolyse
Matériel disponible
- Cuve à électrolyse
- Eau acidifiée (pour une meilleur conduction du courant)
- Générateur de tension continue
- Deux multimètres
- Éprouvettes graduées
Réalisation du montage d’électrolyse
Le principe de ce montage est de faire passer un courant électrique contrôlé dans de l’eau (contenant un peu d’acide sulfurique afin de permettre un meilleur passage du courant).
- Réaliser un tel montage de manière à pouvoir mesurer la tension aux bornes de l’électrolyseur et l’intensité du courant qui le traverse.
- Vous devez pouvoir recueillir le gaz qui se dégage à chaque électrode, sans les mélanger et en pouvant mesurer le volume de gaz recueilli.
- Régler le générateur sur 12 V. Faites fonctionner l’électrolyse pendant le temps nécessaire pour recueillir un volume de gaz suffisant (15 mL au minimum). Mesurer précisemment ce temps.
- Pendant la durée de l’électrolyse, mesurer l’intensité et la tension aux bornes de l’électrolyseur. Agiter régulièrement l’eau acidifiée.
Exploitation de l’électrolyse
- Déterminer la quantité de matière de chaque gaz recueilli. On prendre un volume molaire de 24 L·mol-1
- Identifier ces gaz : approcher une allumette de l’éprouvette graduée contenant le plus grand volume de gaz, et approcher une buchette incandescente de l’éprouvette graduée contenant le plus petit volume de gaz.
- En déduire l’équation-bilan de la réaction.
- Sachant que la dissociation d’une mole d’eau nécessite 282 kJ, estimer le rendement de cette électrolyse.
Éléments de réponses
Après environ 30 minutes d’électrolyse, on obtient environ 26 mL de $*\ce{H2}*$ et 13 mL de $*\ce{O2}*$.
On identifie ces deux gaz (petit pop à l’approche d’une flamme pour le dihydrogène, et le dioxygène ravive une buchette incandescente).
En prenant un volume molaire de 24 L·mol-1, on a produit 1,1 mmol de $*\ce{H2}*$ et moitié moins de $*\ce{O2}*$.
Équation-bilan : $*\ce{H2O → H2 + \frac 12 O2}*$
Énergie chimique stockée : 1,1·10-3×282 = 310 J environ
Valeur de la tension aux bornes de l’électrolyseur : $*U*$ = 6,0 V
Valeur moyenne de l’intensité (elle a un peu fluctué) : $*I*$ = 0,10 A
Énergie électrique fournie à l’électrolyseur : $*E = UI \Delta t =*$ 6×0,1×1900 = 1140 J
Rendement de l’électrolyse : 310÷1140 ≃ 0,27 soit 27 %
Principe
Il est parfois possible d’inverser le sens d’une réaction d’oxydoréduction spontané. Ça nécessite toutefois un apport d’énergie. Une électrolyse consiste à réaliser une réaction d’oxydoréduction non spontanée par un apport d’énergie électrique.
L’exemple classique, vu en TP, est l’électrolyse de l’eau. Elle consiste à inverser le sens de la réaction spontanée de combustion du $*\ce{H2}*$ dans le dioxygène, grâce à un apport d’énergie électrique : $µ \ce{H2O \xrightarrow{\text{énergie}} H2 + \frac 12 O2 } µ$
Électrolyseur
Cette réaction se fait dans un électrolyseur. Un électrolyseur de labo est une simple cuve où sont placées deux électrodes constituées d’un conducteur qui ne va pas interférer chimiquement avec les réactifs lors de l’électrolyse (idéalement du platine, mais 💰 !).
Il arrive également qu’il y ait des réactions « parasites » aux bornes de l’électrolyseur, conduisant à la formation d’espèces chimiques non désirées.

Les électrodes sont reliées à un générateur. Elles sont plongées dans une solution contenant les réactifs. Cette solution doit être conductrice, bien entendu. Dans le cas de l’électrolyse de l’eau, par exemple, on l’acidifie avec quelques gouttes d’acide sulfurique car l’ion oxonium $*\ce{H3O^+}*$ est très conducteur et l’ion sulfate ne réagira pas aux électrodes (du moins tant qu’on reste dans un domaine de tension appropriée).
Aspect énergétique
L’électrolyse transforme l’énergie fournie à l’électrolyseur en énergie chimique (et, bien sûr, en chaleur, car le rendement d’une électrolyse n’est jamais de 100 %).
Accumulateurs
Un accumulateur est une pile « rechargeable ». C’est-à-dire que la réaction d’oxydoréduction qui a lieu lors de sa décharge peut être (idéalement) inversée lorsqu’on force le passage d’un courant à travers la pile.
Dans la pratique, la réalisation d’un accumulateur se heurte à un grand nombre de difficultés techniques : dégradation des électrodes, dégradation de la membrane de séparation des réactifs, réactions parasites au cours de la charge et/ou de la décharge.
C’est pour ces raisons que les accumulateurs :
- n’ont pas une durée de vie infinie mais ne peuvent subir qu’un nombre limité de cycles de charge et de décharge ;
- doivent être rechargé avec un courant d’une intensité adaptée ;
- doivent être utilisés entre un taux de charge et un taux de décharge spécifique – qui dépend de la technologie de l’accumulateur – pour éviter de l’endommager précocement ;
- ont, comme les piles, un « taux d’auto-décharge », qui est le pourcentage de charge perdue (par réaction interne) par unité de temps.
Quelques chiffres sur les accus Lithium-ion
Il existe plusieurs technologies d’accumulateurs au lithium. Elles font toutes appel à des réactions complexes basées sur des composés du lithium. Voici quelques chiffres à propos des accumulateurs lithium-ion :
- Tension à vide : 3,7 V
- Densité énergétique : jusqu’à 265 Wh·kg-1
- Nombre de cycles : environ 1000
- Taux d’auto-décharge : quelques % par an (dans le meilleur des cas)
- Taux limites de charge et de décharge : éviter de dépasser 80 % de charge ou de passer en-dessous de 20 %
- Décharge profonde : en-dessous de charge 5 %, l’accumulateur est irrémédiablement abîmé
- Vitesse de charge : entre 2h et 5h, mais une charge rapide raccourcie la durée de vie de l’accumulateur.
Production de dichlore
Le dichlore Cl2 est obtenu par électrolyse d’une solution de chlorure de sodium.
1. Écrire la demi-équation de réaction électrochimique associée à la formation de dichlore par électrolyse. À quoi correspond cette demi-équation : une oxydation ou une réduction ?
On souhaite obtenir 15 L de dichlore gazeux à partir de la solution électrolysée en 2,0 h.
2. Calculer l’intensité du courant qui doit circuler dans l’électrolyseur. On prendra comme volume molaire d’un gaz $*V_M*$ 24 L·mol-1.
Correction
1. $*\ce{2 Cl^- \rightarrow Cl2 + 2 e^- }*$. Perte d’électrons donc oxydation.
2. On sait qu’il faut arracher 2 moles d’électrons pour produire une mole de dichlore.
15 L de $*\ce{Cl2}*$ représente une qdm de 15÷24 = 0,625 mol.
Il faut 2×0,625 = 1,25 mol d’électrons soit une charge de 1,25×96,5 = 120,625 kC.
$*I*$ = $*\frac Q{\Delta t} =*$ 120625÷(3600×2) = 16,75 A ≃ 17 A.
Recharge d’une batterie au plomb
Lors de sa décharge, un accumulateur au plomb est le siège de la réaction d’équation-bilan : $µ\ce{Pb(s) + PbO2(s) + 4 H^+(aq)\rightarrow 2 Pb^2+(aq)+ 2 H2O(\ell)}µ$
Pour recharger complètement cette batterie, il faut 6 h avec un courant d’intensité égale à 7,8 A.
1. Écrire l’équation de la réaction qui a lieu lors de la charge de cette batterie.
2. Déterminer l’augmentation de la masse de l’électrode de plomb (où viennent se fixer les ions P$*\ce{b^2+}*$ transformés en $*\ce{Pb(s)}*$ ) lors de la charge complète de l’accumulateur.
Correction
La réaction se fait dans le sens opposé.
2. $*Q = I\Delta t*$ = 7,8×6 = 46,8 A·h = 168,5 kC
Qdm d’électrons échangés : $*n_e*$ = 1,75 mol
Chaque ion $*\ce{Pb^2+}*$ reçoit deux électrons, donc la qdm de plomb solide formée est de : 1,75÷2 = 0,875 mol.
La masse de plomb formée vaut donc : 0,875×207,2 ≃ 181 g.
Placage à l’or
Un placage à l’or consiste à déposer une fine couche d’or (3 µm d’épaisseur) sur un objet métallique.
Cette couche d’or peut être déposée par électrolyse grâce à une solution aqueuse de chlorure d’or (Au3+ ; 3 Cl–) et une électrode en platine. Le support à plaquer compose la deuxième électrode de ce système.
L’intensité du courant électrique lors de cette électrolyse est de 1,0 A.
On souhaite plaquer d’or un bijou en argent d’une surface $*S*$ = 1 cm2. À la fin de cette opération, la concentration de la solution de chlorure d’or ne doit pas être inférieure à 0,1 mol·L-1. Le volume initial de solution est de 200 mL.
Donnée : masse volumique de l’or $*\rho_\text{or}*$ = 19,3 g·cm-3
1. Indiquer à quelle borne du générateur le bijou doit être connecté.
2. Combien de temps durera l’électrolyse ?
3. Quelle doit être la concentration initiale minimale de la solution de chlorure d’or ?
Correction
1. Les ions or doivent recevoir des électrons, donc le bijou doit pouvoir leur en donner, c’est-à-dire être connecté à la borne ⊖ du générateur.
2. Volume d’or nécessaire : $*V*$ = 1×3·10-4 = 3·10-4 cm3
Masse d’or nécessaire : $*m*$ = 3·10-4×19,3 = 5,79 mg
Qdm d’or nécessaire : $*n*$ = 5,79·10-3÷197 = 29,4 µmol
Chaque ion or, nécessite 3 électrons, donc :
Qdm d’électrons nécessaires $*n_e*$ = 88,2 µmol
Charge nécessaire : $*Q*$ = 88,2·10-6×96,5·103 = 8,51 C
Durée nécessaire : $*\Delta t = \frac QI =*$ 8,5 s
3. On veut qu’il y ait $*n*$ = 0,1×0,2 = 20 mmol d’ions $*\ce{Au^3+}*$ dans la solution à la fin de la réaction.
Or, on en a consommé 29,4 µmol, ce qui est négligeable devant la quantité restante.
Donc on peut utiliser, au départ, une solution à 0,1 mol·L-1.
Révision & entraînement
Production d’eau de javel
L’ion hypochlorite, désinfectant présent dans l’eau de javel et dans l’eau des piscines, peut être produit par électrolyse d’une solution de chlorure de sodium.
Lors de cette électrolyse, il y a d’abord production de dichlore $*\ce{Cl2}*$.
On plonge deux électrodes chimiquement inerte (en titane, par exemple) dans une solution aqueuse de chlorure de sodium. Ces électrodes sont reliées à un générateur de tension continue.
Données
- constante de Faraday ℱ = 96,5 kC·mol-1.
- Les deux couples impliqués sont $*\ce{Cl2(g)/Cl–(aq)}*$ et $*\ce{H2O(ℓ)/H2(g)}*$.
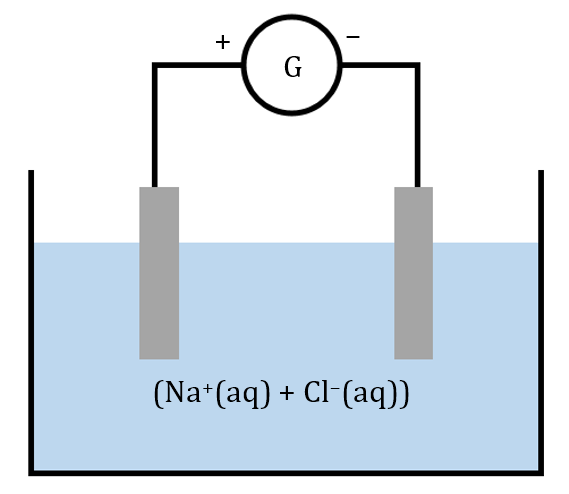
1. Donner les demi-équations d’oxydoréduction qui se déroulent à chaque électrode. Indiquer à quel pôle du générateur (⊕ ou ⊖) l’électrode associée à chaque demi-équation est reliée.
Dans un deuxième temps, les ions $*\ce{HO–}*$ apparus à cause de l’électrolyse réagissent avec le dichlore produit pour le transformer en ion hypochlorite selon la réaction (supposée totale) $*\ce{Cl2 + 2 HO– → ClO– + Cl– + H2O}*$.
2. Justifier que, au cours de l’électrolyse, des ions $*\ce{HO–}*$ sont produits.
3. Le courant qui circule a une intensité de 2,0 A. Calculer la quantité de $*\ce{ClO–}*$ produite après une heure d’électrolyse, en supposant que les ions chlorure sont en large excès.
4. L’eau de javel a une concentration d’environ 0,5 mol·L-1 en ions hypochlorite. Si on réalise l’électrolyse d’un litre de solution de chlorure de sodium à 1 mol·L-1 dans ces conditions ($*I*$ = 2,0 A), au bout de combien de temps a-t-on transformé cette solution en eau de javel ? La concentration initiale en chlorure de sodium est-elle suffisante ?
Correction
1. Production de dichlore donc $*\ce{2 Cl– → Cl2 + 2 e–}*$ (oxydation)
Donc à l’autre électrode, il y a une réduction : $*\ce{H2O + 2 e– + 2 H+ → H2 + H2O}*$. que l’on peut simplifier en $*\ce{2 e– + 2 H+ → H2}*$
Oxydation : pôle ⊕ du générateur (qui attire les électrons à lui).
Réduction : pôle ⊖
2. Les ions $*\ce{H+}*$ nécessaires à la production de $*\ce{H2}*$ sont donnés par les molécules d’eau, qui se transforment alors en ions $*\ce{HO^-}*$.
3. Le bilan global des deux réactions est : $*\ce{H2O + 2 H+ + Cl– → H2 + ClO–}*$ (échange de 2 $*\ce{e–}*$)
Donc il faut 2 mol d’$*\ce{e–}*$ pour chaque mole de $*\ce{ClO–}*$ produite.
Charge totale ayant circulé pendant 1 h : $*Q*$ = 2×3600 = 7,2 kC
Qdm d’$*\ce{e–}*$ échangés : 74,6 mmol.
Qdm de $*\ce{ClO–}*$ produits : 37,3 mmol
4. Il faut produire 0,5 mol de $*\ce{ClO–}*$ ce qui nécessite la même qdm de $*\ce{Cl–}*$, or il y en a le double, donc c’est bien suffisant.
Par une proportionnalité : 1 h → 37,3 mmol de $*\ce{ClO–}*$, quelle durée pour 500 mmol ? 500÷37,3 = 13,4 h.