C8. Molécules organiques
Les molécules organiques sont classées par famille. Certaines ont été vues au chapitre C8 de première, nous allons en voir d’autres dans ce chapitre. Il est très important que vous alliez vous rafraîchir la mémoire sur ce sujet et je considèrerai comme parfaitement su le cours de première à l’évaluation sur ce chapitre.
Familles de molécules organiques
- Exploiter des règles de nomenclature fournies pour nommer une espèce chimique ou représenter l’entité associée.
- Utiliser un logiciel de simulation de structures moléculaires et des modèles moléculaires.
Formule topologique
Jusqu’à présent, vous vous serviez d’une des formules développées et semi-développées en chimie organique. Un petit rappel très rapide, en prenant l’exemple de la molécule de butan-2-ol :
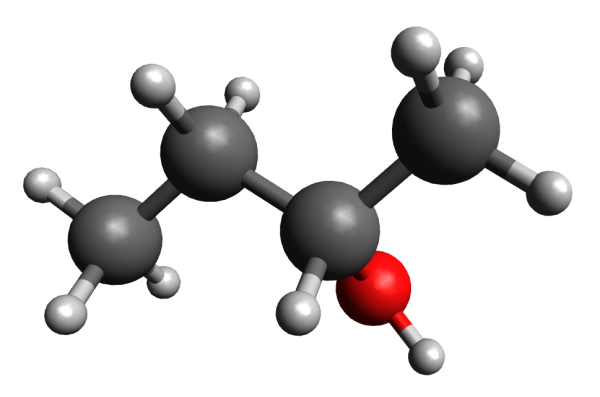
Ce que vous savez déjà
Ne perdez pas de vue qu’en écrivant une formule, le chimiste a pour but de décrire de manière univoque une molécule. Ce n’est pas le cas, par exemple de la formule brute, qui ne sert qu’à calculer la masse molaire. En effet, derrière une formule brute peuvent se cacher de nombreux isomères différents.
Formule développée : on y fait figurer toutes les liaisons et tous les atomes. Elle ne tient aucun compte de la géométrie de la molécule.
Comme vous le voyez, c’est lourd et peu lisible, surtout si la molécule est grosse. Les chimistes ne se servent jamais de la formule développée, qui est vue au collège et en seconde uniquement pour des raisons pédagogiques.
On peut garder les mêmes informations de structures de la molécule en utilisation une notation plus compacte.
Formule semi-développée : même chose que la formule développée, sauf qu’on regroupe les hydrogène sur les atomes qui les portent. En effet, comme l’hydrogène ne peut faire qu’une seule liaison, cela ne crée aucune ambigüité.
C’est déjà plus lisible ! 😊 Et plus simple à écrire, tant à la main qu’à l’ordinateur. Mais, si vous voulez représenter de grosses molécules, ça peut encore être une écriture assez lourde.
Alors il y a mieux. Beaucoup mieux. 😎
Les chimistes ont donc inventé la formule topologique. Sobre, simple et élégante, c’est elle qui est utilisée en chimie organique.
Le principe est simple : on n’écrit plus les carbone, mais seulement les liaisons carbone-carbone, représentées par des segments, en veillant à faire figurer un angle entre deux liaisons carbone-carbone successives. Et puis on n’écrit plus non plus les hydrogène portés par les carbone, puisqu’il suffit de se rappeler que le carbone est tétravalent pour en déduire combien d’hydrogène porte chaque carbone de la molécule.
On voit tout de suite clairement la structure de la molécule, ainsi que les groupes caractéristiques qu’elle porte.
Remarquez que l’hydrogène porté par l’oxygène figure explicitement dans cette formule, comme dans une formule semi-développée.
Formules topologiques
1. Donner les formules semi-développées des molécules suivantes :
2. Donner les formules topologiques des molécules suivantes :
Correction
1. Formules semi-développées
2. Formules topologiques
Familles de molécules
Vous avez déjà vu, en première, les familles organiques suivantes : alcanes, alcools, aldéhydes, cétones et acides carboxyliques (ces derniers ont été revus au chapitre C1 de Tale) ainsi que les amines (chapitre C1 de Tale).
On va voir encore quelques nouvelles familles.
Halogénoalcanes
Comme le nom de la famille l’indique, il s’agit d’alcanes dont un ou plusieurs hydrogène (ou même tous) ont été substitués par un halogène ($*\ce{F}*$, $*\ce{Cl}*$, $*\ce{Br}*$, $*\ce{I}*$).
Exemples
Amines
On a vu au chapitre C1, brièvement, les amines. Une amine est un composé organique dérivé de l’ammoniac dont au moins un atome d’hydrogène a été remplacé par un groupe alkyle (noté $*\ce{R}*$ ci-dessous). Les amines présentent également un caractère basique. Leur acide conjugué s’appelle l’ion alkylammonium.
Pour trouver le nom d’une amine, la chaîne carbonée principale, celle qui va donner le radical du nom, doit être la plus longue.
Exemples
Esters
Les esters sont des acides carboxyliques pour lesquels l’hydrogène « acide » (celui lié à l’oxygène) a été substitué par un groupe alkyle.
Leur nom se forme à partir du nom de l’acide carboxylique associé (par exemple acide butanoïque) ou plus exactement de la base conjuguée de cet acide (par exemple (ion) butanoate) et de celui du groupe alkyle ayant substitué l’hydrogène.
Exemples
Amides
Une amide se termine par le groupe amide 😊 qui se situe forcément en bout de chaîne.
$*\ce{R_1}*$ et $*\ce{R_2}*$ peuvent être des groupes alkyles ou des hydrogène.
Pour ce qui est de leur nomenclature, je vous la laisse deviner à partir des exemples ci-dessous. Il n’y a rien de bien compliqué. 😊
Exemples
Squelettes carbonés
Les familles chimiques ne sont pas uniquement basées sur la présence ou non d’un groupe fonctionnel. Elles dépendent aussi de la présence de liaisons doubles ou triples dans le squelette carboné.
Les alcènes
Un alcène est un hydrocarbure (donc composés exclusivement de C et de H, comme les alcanes), comportant une double liaison.
Leurs noms finissent en « -ène », la position de la double liaison doit être indiquée s’il y a ambigüité et la chaîne carbonée principale est la plus longue chaîne qui contient la double liaison.
L’alcène le plus simple est l’éthène ci-dessous.
Une petite subtilité existe à cause du fait qu’il n’y ait pas libre rotation autour de la double liaison C=C. Les deux molécules ci-dessous ne sont pas identiques (ce sont donc des isomères), si a ≠ b et c ≠ d, où a, b, c et d représentent des atomes ou des groupes d’atomes quelconques.
Si le plus lourd des deux groupes a et b et le plus lourd des deux groupes c et d se retouvent du même côté de la double liaison, on a alors l’isomère Z (pour zusammen – « ensemble » en allemand). Sinon, on a l’isomère E (pour entgegen – « opposé » en allemand).
Cette isomérie n’existe bien-sûr pas si l’un au moins des deux carbone impliqués dans la double liaison est lié à deux atomes ou deux groupes d’atomes identiques.
Dans l’exemple ci-dessous a et b représentent –H et –CH3, de même que c et d. Il y a donc, dans ce cas, isomérie de type Z/E
Par contre, dans la molécule ci-dessous, il ne peut y avoir d’isomérie Z/E
Exemples
Remarque : les composés possédant plus d’une double liaison ne sont pas des alcènes, mais appartiennent encore à d’autres familles (diène, allènes, polyènes…). On n’en parlera pas, mais sachez qu’elles existent.
Les alcynes
Les alcynes sont des hydrocarbures comptant une triple liaison. Ils sont extrêmement inflammables.
Exemples
Composés cycliques
Bonne nouvelle, la présence ou non d’un cycle n’a aucune influence sur l’appartenance à telle ou telle famille d’une molécule. 😊 Les règles de nomenclature sont strictement les mêmes que lorsqu’il n’y a pas de cycle. Attention cependant, le cycle n’appartient pas forcément à la chaîne principale. Dans ce cas, il est compté comme une ramification (cyclopentyle, cyclohexyle…)
Pour ce qui est de sa numérotation, on numérote le cycle de manière à ce que le carbone fonctionnel ait le numéro 1 et on tourne dans le sens à minimiser les numéros des carbones portant les ramifications.
Exemples
Nomenclature
1. Nommer les molécules ci-dessous :
2. Donner la formule topologique du 2,3,3-triméthylbutan-1,2-diol et du N,N,2,2-tetraméthylpropanamide.
Correction
1. (a) 3-méthylbutan-2-ol – (b) pentanal – (c) N,N,2-triméthylpropanamide – (d) 2,3-diméthylbutanoate d’éthyle – (e) 1-chloro-2,2-difluorobutane – (f) 2-méthylcyclopentanone
2. Formules topologiques
Isomérie de constitution
- Représenter des formules topologiques d’isomères de constitution, à partir d’une formule brute ou semi-développée.
Deux espèces chimiques distinctes sont isomères si elles ont la même formule brute.
Deux molécules qui ont la même formule brute mais qui ont des formules semi-développées différentes sont appelés isomères de constitution.
Il existe un deuxième type d’isomérie, qui n’est pas au programme mais que je mentionne pour votre culture, c’est la stéréoisomérie. Deux stéréoisomères ont la même formule semi-développée, mais des structures tridimensionnelles différentes.
Parmi les isomères de constitution, on peut faire plusieurs catégories :
- Isomères de chaînes : ils diffèrent par leur chaîne carbonée, mais appartiennent à la même famille. Par exemple, le butane et le méthylpropane.
- Isomérie de position de fonction : je crois que ce type d’isomérie parle de lui-même… 😊
- Isomérie de nature de fonction : les groupes fonctionnels de ces isomères sont différents.
- Isomérie d’insaturation : la nature de l’insaturation est différente (par exemple, le propène et le cyclopropane, ou encore la présence d’une liaison triple ou lieu de deux liaisons double.)
Isomérie
1. Donner la formule topologique de tous les composés de formule brute $*\ce{C_3H_8O}*$. Donner également le nom de ces composés lorsqu’ils appartiennent à une famille que vous connaissez.
2. Illustrer chaque type d’isomérie de constitution par deux composés de formule brute $*\ce{C6H10O2}*$.
3.a. Donner la formule topologique du 2,2-dichloropropane ainsi que d’un isomère de position de fonction de cette espèce.
3.b. Donner la formule topologique du pentanal ainsi que d’un isomère de nature de fonction de cette espèce.
3.c. Donner la formule topologique du pent-1-yne ainsi que d’un isomère d’insaturation de cette espèce.
Correction
1. Il y a trois composés différents.
2. Isoméries
Pour illustrer correctement l’isomérie d’insaturation, il faut prendre deux autres exemples.
3.a.
3.b.
3.c.
Polymères
- Identifier le motif d’un polymère à partir de sa formule.
- Citer des polymères naturels et synthétiques et des utilisations courantes des polymères.
Définitions
Un polymère est une macromolécule formée par l’enchaînement de motifs monomères identiques. On les obtient à partir d’une molécule appelée monomère, qu’on lie à d’autres molécules identiques pour former le polymère.
Le mieux est de prendre un exemple très simple : le polyéthylène. La formule de ce polymère s’écrit :
Cette notation signifie que le polyéthylène est formé par la répétition du motif monomère indiqué entre parenthèses – typiquement plusieurs centaines de répétitions.
Le polyéthylène est fabriqué par polymérisation d’un monomère : l’éthène (aussi appelé « éthylène », d’où le nom de « polyéthylène »).
Polymères naturels et synthétiques
Les polymères existent à l’état naturel : cellulose, amidon, lignigne (constituant du bois), kératine (cheveux et ongles) sont des polymères naturels.
Les polymères synthétiques forment les plastiques (et d’autres composés, telle que la silicone).
Ils ont donc une importance industrielle de premier ordre, et sont également au premier plan des préoccupations écologiques depuis de nombreuses années.
Formules de polymère
1. Donner la formule du polypropylène, formé à partir de propène.
2. Donner la formule du polychlorure de vinyl, formé à partir de chloroéthène.