C1. Acides & base
Nous avons vu en première un type de réaction particulier : les réactions d’oxydo-réduction, caractérisées par un échange d’électrons entre les réactifs. Nous allons voir dans ce chapitre une autre grande catégorie de réaction : les réactions acide-base.
Réactions acide-base
- Identifier un transfert d’ion hydrogène, les couples acide-base mis en jeu et établir l’équation d’une réaction acide-base.
- Identifier le caractère amphotère d’une espèce chimique.
Acides & bases
Selon la définition de Brønsted :

Un acide au sens de Brønsted comporte donc forcément un atome d’hydrogène, puisqu’il doit pouvoir en céder un. Sa formule générale peut s’écrire $*\ce{AH}*$, le $*\ce{A}*$ étant toute la molécule ou l’ion à l’exception du $*\ce{H}*$ qui peut être cédé (on parle d’hydrogène labile).
Pour qu’un hydrogène soit « labile » (on dit aussi qu’il a un caractère « acide »), il faut qu’il soit lié à un atome sensiblement plus électronégatif que lui, et donc que cette liaison soit polarisée. L’hydrogène labile est toujours porteur, au départ, d’une charge δ+.
Une liaison $*\ce{C-H}*$ est très faiblement polarisée, donc les hydrogène liés à un atome de carbone n’ont pas de caractère acide.
Il n’y a pas vraiment de « formule générale » pour une base. On la note souvent $*\ce{B}*$.
Une base doit être capable de capter un ion $*\ce{H+}*$. Il faut donc qu’elle dispose d’un atome électronégatif ayant un doublet non liant.
Si ce n’est pas clair, on va bientôt faire un exercice là-dessus. 😊
Espèce amphotère
Une espèce chimique est dite amphotère si elle peut à la fois se comporter comme un acide et comme une base (selon le réactif avec qui elle réagit).
Le cas le plus courant est celui de l’eau : la molécule d’eau peut céder un ion $*\ce{H+}*$ ($*\ce{H2O \rightleftarrows HO- + H+}*$) et donc se comporter comme un acide, mais elle peut également accepter un ion $*\ce{H+}*$ ($*\ce{H2O + H+ \rightleftarrows H3O+}*$) et donc se comporter comme un base.
Réaction acide-base
Une réaction acide-base est un échange d’ion $*\ce{H+}*$ entre un acide et une base.
On peut écrire sa forme générale :
Quelques réactions acide-base
Voici quelques réactions acide-base :
1. $*\ce{HNO3 + H2O \rightarrow NO3- + H3O+} *$
2. $*\ce{NH2- + H2O \rightarrow NH3 + HO-} *$
3. $*\ce{CH3COOH + HO– \rightarrow CH3COO– + H2O}*$
4. $*\ce{CH3COO– + NH4+ \rightleftarrows CH3COOH + NH3}*$
Pour chacune d’entre elles, indiquer quel réactif joue le rôle d’acide et quel réactif joue le rôle de base.
Correction
Liste des acides (l’autre réactif étant la base) :
1. $*\ce{HNO3}*$
2. $*\ce{H2O}*$
3. $*\ce{CH3COOH}*$
4. $*\ce{NH4+}*$
Couples acide-base
Vous avez certainement remarqué, dans les exemples précédents, qu’un acide $*\ce{AH}*$ qui a perdu son $*\ce{H+}*$ et s’est transformé en $*\ce{A-}*$ peut de nouveau récupérer un ion $*\ce{H+}*$ pour former l’acide $*\ce{AH}*$.
Par conséquent, $*\ce{A-}*$ est une base. On dit que c’est la base conjuguée de $*\ce{AH}*$.
Ainsi, chaque acide possède une base conjuguée et réciproquement, chaque base possède un acide conjugué. Un acide et sa base conjuguée forment un couple acide-base. Un couple acide base est noté conventionnellement avec l’acide en premier et la base ensuite, comme ceci : $*\ce{AH/A-}*$.
Couples acide-bases
Donner les couples acide-base mis en jeu dans les réactions données à l’exercice précédent.
Repérer les espèces amphotères.
Correction
1. $*\ce{HNO3/NO3-}*$ et $*\ce{H3O+/H2O}*$
2. $*\ce{H2O/HO-}*$ et $*\ce{NH3/NH2-}*$
3. $*\ce{CH3COOH/CH3COO-}*$ et $*\ce{H2O/HO-}*$
4. $*\ce{NH4+/NH3}*$ et $*\ce{CH3COOH/CH3COO-}*$
Espèces amphotères : $*\ce{H2O}*$ et $*\ce{NH3}*$
Acides et bases courants
- Citer des solutions aqueuses d’acides et de bases courantes et les formules des espèces dissoutes associées : acide chlorhydrique $*\ce{(H3O+(aq), Cl–(aq))}*$, acide nitrique $*\ce{(H3O+(aq), NO3–(aq))}*$, acide éthanoïque $*\ce{CH3COOH(aq)}*$, soude ou hydroxyde de sodium $*\ce{(Na+(aq), HO–(aq))}*$, ammoniac $*\ce{NH3(aq)}*$.
- Représenter le schéma de Lewis et la formule semi-développée d’un acide carboxylique, d’un ion carboxylate, d’une amine et d’un ion alkylammonium.
Solutions courantes d’acides et de bases forts
Très utilisées au labo, vous devez savoir par cœur le nom et la formule de ces solutions, ainsi que le nom des ions qu’elles contiennent :
- Acide chlorhydrique : $*\ce{(H3O+(aq), Cl–(aq))}*$
- Acide nitrique : $*\ce{(H3O+(aq), NO3-(aq))}*$
- Soude ou hydroxyde de sodium (base) : $*\ce{(Na+(aq), HO-(aq))}*$
Dans ces solutions, l’espèce acide est l’ion $*\ce{H3O+}*$, appelé ion oxonium et l’espèce basique est l’ion $*\ce{HO-}*$, appelé ion hydroxyde. Leur contre-ion ($*\ce{Cl-}*$ (chlorure), $*\ce{NO3-}*$ (nitrate) ou $*\ce{Na+}*$ (sodium) ) ne joue aucun rôle acido-basique.
Les acides carboxyliques
Nous avons vu l’année dernière (chapitre C8) une famille organique appelée acide carboxylique. La liaison $*\ce{O-H}*$ du groupe carboxyle (en rouge) est fortement polarisée (l’oxygène doublement lié au carbone accentue encore cette polarisation).
Rappelez-vous la structure de Lewis des quatre éléments les plus courants dans une molécule organique :
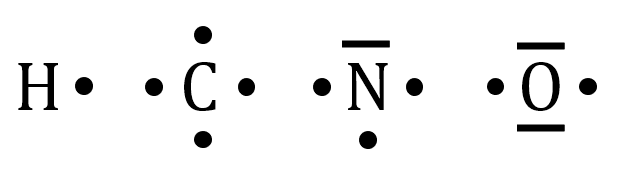
En présence d’une base (l’eau par exemple), la liaison polarisée peut se rompre. L’ion $*\ce{H+}*$ ainsi libéré est capté par la base et l’acide carboxylique se transforme en sa base conjuguée : un ion carboxylate.
L’équation-bilan de la réaction (avec l’eau) est :
$µ\ce{R-COOH + H2O ⇄ R-COO- + H3O+}µ$
L’acide éthanoïque
1. Donner la formule de Lewis et la formule semi-développée de l’acide éthanoïque.
2. Écrire l’équation-bilan de la réaction de l’acide éthanoïque sur l’eau, puis celle de ce même acide avec l’ion hydroxyde $*\ce{HO-}*$.
Correction
1. Formule semi-développée et modèle de Lewis de l’acide éthanoïque
2. $* \ce{CH3CO2H + H2O \rightleftarrows CH3CO2^- + H3O+} *$ et
$* \ce{CH3CO2H + HO- \rightleftarrows CH3CO2^- + H2O} *$
L’ammoniac et les amines
L’ammoniac $*\ce{NH3}*$ a un caractère basique. Son acide conjugué est l’ion ammonium de formule $*\ce{NH4+}*$.
Une amine est un composé organique dérivé de l’ammoniac dont au moins un atome d’hydrogène a été remplacé par un groupe alkyle (noté $*\ce{R}*$ ci-dessous). Les amines présentent également un caractère basique. Leur acide conjugué s’appelle l’ion alkylammonium.
L’éthylamine
L’éthanamine $*\ce{CH3-CH2-NH2}*$ réagit partiellement avec l’eau par une réaction acido-basique.
1. Donner l’équation-bilan de cette réaction.
2. Donner la formule de Lewis de l’ion éthylammonium
Correction
1. $* \ce{CH3-CH2-NH2 + H2O \rightleftarrows CH3-CH2-NH3+ + HO-} *$
2. Modèle de Lewis de l’ion éthylammonium
Le dioxyde de carbone
Le dioxyde de carbone $*\ce{CO2}*$ possède indirectement un caractère acide.
Eh bien c’est un peu compliqué, mais pas tant que ça 😊. En fait, le $*\ce{CO2}*$ à l’état gazeux peut se dissoudre partiellement dans l’eau lorsqu’il rentre en contact avec elle. Ceci peut s’écrire : $µ \ce{CO2(g) ⇄ CO2(aq)} \tag{0} µ$
S’en suit alors une première réaction non totale du $*\ce{CO2}*$ avec l’eau qui a pour équation-bilan : $µ \ce{CO2(aq) + H2O(\ell) ⇄ H2CO3(aq)} \tag{1} µ$
La molécule $*\ce{H2CO3}*$ est appelée acide carbonique. Et c’est elle qui a des propriétés acides. En effet, une fois qu’elle apparaît, elle peut réagir avec l’eau selon l’équation : $µ \ce{H2CO3(aq) + H2O(\ell) ⇄ HCO3-(aq) + H3O+} \tag{2} µ$
L’ion hydrogénocarbonate $*\ce{HCO3-}*$ a lui-même des propriétés acides. Il peut réagir avec l’eau selon l’équation : $µ \ce{HCO3-(aq) + H2O(\ell) ⇄ CO3^2-(aq) + H3O+} \tag{3} µ$
Les réactions (1) et (2) sont parfois « fusionnées » en une seule et notées : $µ \ce{(CO2,H2O) + H2O(\ell) ⇄ HCO3^-(aq) + H3O+} \tag{1-2} µ$
Ainsi, vous verrez le plus souvent les couples acide-base impliquant le dioxyde de carbone sous la forme $*\ce{CO2,H2O/HCO3-}*$ et $*\ce{HCO3-/CO3^2-}*$.
Le pH
- Déterminer, à partir de la valeur de la concentration en ions oxonium $*\ce{H3O+}*$, la valeur du pH de la solution et inversement.
- Capacité mathématique : utiliser la fonction logarithme décimal et sa réciproque.
Vous avez vu au collège que le pH est un nombre qui donne une indication sur le caractère acide ou basique d’une solution aqueuse. Mais à quoi correspond ce nombre ?
Le pH est défini par la relation : $µ \mathrm{pH} = -\log \left( { \ce{[H3O+]} \over c^\mathrm{o}} \right) µ$
Oui. Ça mérite bien quelques petites explications :
- log : il s’agit de la fonction logarithme en base 10, aussi appelée logarithme décimal. Évident, non ? 😑
Vous verrez en math plusieurs propriétés très intéressantes de cette famille de fonctions. Tout ce que vous avez besoin de savoir pour l’instant, c’est que $* \log 10^x = x *$. Pour le reste, la calculatrice fera le boulot pour vous. Attention, ne confondez pas les fonctions « log » et « ln » sur votre calculatrice. - $*\ce{[H3O+]}*$ : il s’agit de la concentration, en mol·L-1 de l’ion $*\ce{H3O+}*$. Nous avons déjà vu l’année dernière qu’en chimie, une espèce notée entre crochets signifie que l’on parle de sa concentration molaire. Retenez-le bien, nous allons nous servir abondamment de cette notation.
- $* c^\mathrm{o} *$ : il s’agit de la concentration de référence, soit 1 mol·L-1.
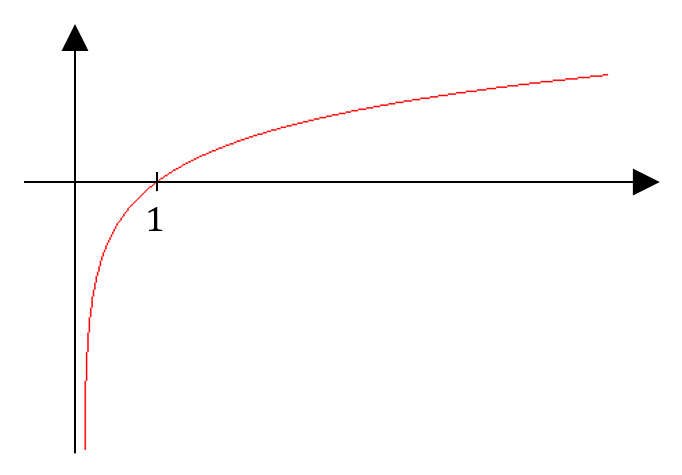 Remarquez qu’il s’agit de fonctions croissantes, négatives avant 1 et positive après, et qu’elles ne sont
pas définies sur $*\mathbb{R}^-*$
Remarquez qu’il s’agit de fonctions croissantes, négatives avant 1 et positive après, et qu’elles ne sont
pas définies sur $*\mathbb{R}^-*$Bien vu ! Et c’est (presque) vrai. En fait, on n’a pas le droit d’appliquer des fonctions mathématiques à des valeurs comportant des unités. log (0,1 mol·L-1), ça ne veut rien dire ! log (0,1) si ! Le rôle de $* c^\mathrm{o} *$ est simplement de faire disparaître les unités de $*\ce{[H3O+]}*$.
C’est bien compliqué pour pas grand-chose, me direz-vous. Sur la calculatrice, on ne tape pas les unités, donc on se fiche de ce $* c^\mathrm{o} *$ ! Et vous auriez d’autant plus raison que les chimistes ne font pas toujours preuve d’une grande rigueur mathématique... 😏
D’ailleurs, aucun d’entre eux n’écrit la formule telle que je vous l’ai présentée plus haut. Mais bon, ils savent tous qu’il s’agit d’un « abus de notation » mathématique. Quoiqu’il en soit, pour le reste de l’année, nous utiliserons la formule simplifiée :
en nous rappelant bien qu’en fait, on ne prend pas vraiment $*\ce{[H3O+]}*$ mais la valeur numérique de $*\ce{[H3O+]}*$ exprimée en mol·L-1
À 25°C, un pH inférieur à 7 signifie que la solution est acide.
Un pH inférieur à 2 indique que la solution est très acide. S’il est supérieur à 12, cela signifie que la solution est très basique.
Pour calculer la valeur de $*\ce{[H3O+]}*$ en mol·L-1 connaissant le pH, il faut utiliser la fonction réciproque du logarithme décimal, à savoir $*10^x*$.
TP Définition du pH
- Mesurer le pH de solutions d’acide chlorhydrique $*\ce{(H3O+(aq), Cl–(aq))}*$ obtenues par dilutions successives d’un facteur 10 pour tester la relation entre le pH et la concentration en ions oxonium $*\ce{H3O+}*$ apportés.
- Réaliser des mesures de pH.
Objectif : tester la relation de définition du pH.
Matériel disponible
- Une solution d’acide chlorhydrique à 1,0·10-2 mol·L-1 ;
- Un pH-mètre ;
- De l’eau distillée et de la verrerie courante.
Travail demandé
- Décrire une expérience qui vous permettra de tester la relation de définition du pH : $* \mathrm{pH} = -\log \ce{[H3O+]} *$. Attention : pour être sûr d’une relation, il faut faire plusieurs mesures. 😊
- Écrire le protocole précis de la dilution d’une solution mère d’un facteur 10.
- Après validation de votre travail par votre professeur, vous pouvez réaliser les expériences que vous avez proposées.
✋ Attention : lisez d’abord le guide pour étalonner le pH-mètre et pour mesurer un pH. - Exploitez vos mesures pour dire si oui ou non, elles vous paraissent en accord avec la relation de définition du pH
Correction
Expérience pour tester la relation de définition du pH
• Mesurer le pH de la solution mère d’acide chlorhydrique et la comparer à la valeur attendue.
• Diluer cette solution-mère pour obtenir deux ou trois solutions-filles, mesurer leur pH et comparer à la valeur attendue.
Protocole dilution facteur 10
Supposons qu’on veuille 100 mL de solution fille.
• Prélever 10 mL de solution-mère avec une pipette jaugée et les verses dans la fiole jaugée de 100 mL.
• Complèter avec de l’eau distillée jusqu’au trait de jauge.
• Boucher et agiter.
Validation des mesures
On constate que le résultat des mesures est très proche de la valeur attendue (pas plus de quelques 100e d’écart sur la valeur du pH).
pH et concentration en H3O+
1. Calculer le pH de solutions aqueuses pour lesquelles $*\ce{[H3O+]}*$ a les valeurs suivantes :
a. 0,010 mol·L-1 ;
b. 0,020 mol·L-1 ;
c. 15 mmol·L-1 ;
2. Calculer $*\ce{[H3O+]}*$ pour les solutions aqueuses dont le pH a les valeurs suivantes :
a. 3 ;
b. 2,5 ;
c. 0 ;
Correction
1.a pH = 2 ; 1.b pH = 1,70 ; 1.c pH = 1,82
2.a 1,0 mmol·L-1 ; 2.b 3,2 mmol·L-1 ; 2.c 1,0 mol·L-1.
Révision & entraînement
Révisez le tableau d’avancement pour faire l’exercice ci-dessous.
pH d’un mélange acide-base
On mélange un volume $*V_A*$ = 100 mL d’acide chlorhydrique de concentration $*c_A*$ = 50 mmol·L-1 avec un volume $*V_B*$ = 70 mL de soude de concentration $*c_B*$ = 50 mmol·L-1.
Sachant que la réaction entre l’ion oxonium et l’ion hydroxyde est totale, calculer le pH final du mélange.
Correction
Qdm initiale d’ion oxonium : $*n_\ce{H3O+} = c_AV_A = *$ 50·10-3×100·10-3 = 5,0 mmol
Qdm initiale d’ion hydroxyde : $*n_\ce{HO-} = c_BV_B = *$ 50·10-3×70·10-3 = 3,5 mmol
Il faut se rappeler que l’ion oxonium est un acide alors que l’ion hydroxyde est une base. Il y a donc entre eux une réaction acide-base.
À partir de là, on peut utiliser un tableau d’avancement, ou pas, car la réaction est très simple. Je vais l’utiliser pour vous rafraîchir la mémoire.
| $*x*$(mmol) | $*\ce{H3O+ \; + \; HO- \; \rightarrow \; 2H2O}*$ | ||
|---|---|---|---|
| 0 | 5 | 3,5 | solvant |
| $*x*$ | 5 - $*x*$ | 3,5 - $*x*$ | |
| $*x_{max}*$ = 3,5 | 1,5 | 0 | |
En fin de réaction, il reste donc 1,5 mmol de $*\ce{H3O+}*$ dans un volume de 170 mL. Donc $*\ce{[H3O+]}*$ = 8,8 mmol·L-1.
Le pH final du mélange vaut donc $*-\log [\ce{H3O+}] =*$ 2,05.